Química
Exibindo questões de 201 a 300.
Um dos pilares da nanotecnologia é o fato de as - UNICAMP 2020
Química - 2020Um dos pilares da nanotecnologia é o fato de as propriedades dos materiais dependerem do seu tamanho e da sua morfologia. Exemplo: a maior parte do H2 produzido industrialmente advém da reação de reforma de hidrocarbonetos: CH4(g) + H2O(g) → 3H2(g) + CO(g). Uma forma de promover a descontaminação do hidrogênio é reagir o CO com largo excesso de água:
CO(g) + H2O(g) → CO2(g) + H2(g); ΔH = –41,6 kJ mol–1.
A figura abaixo mostra resultados da velocidade (em unidade arbitrária, ua) dessa conversão em função da temperatura, empregando-se um nanocatalisador com duas diferentes morfologias.
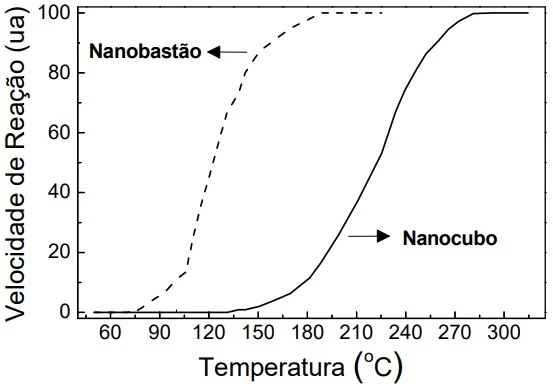
“O sal faz a água ferver mais rápido?” Essa é uma - UNICAMP 2020
Química - 2020“O sal faz a água ferver mais rápido?” Essa é uma pergunta frequente na internet, mas não tente responder com os argumentos lá apresentados. Seria muito difícil responder à pergunta tal como está formulada, pois isso exigiria o conhecimento de vários parâmetros termodinâmicos e cinéticos no aquecimento desses líquidos. Do ponto de vista termodinâmico, entre tais parâmetros, caberia analisar os valores de calor específico e de temperatura de ebulição da solução em comparação com a água pura.
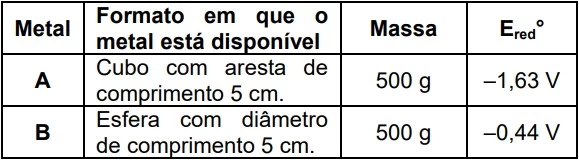
Para ser usado em um implante dentário, um metal ou - UNICAMP 2020
Química - 2020Para ser usado em um implante dentário, um metal ou liga precisa apresentar excelente compatibilidade com o organismo, alta resistência mecânica e boa flexibilidade, entre outros atributos. Imagine que dois metais, A e B, tenham sido testados quanto à sua aplicação em um implante, e o metal A foi considerado a melhor opção.
A catástrofe de Tchernóbil (1986) foi o mais grave -UNICAMP 2020
Química - 2020A catástrofe de Tchernóbil (1986) foi o mais grave desastre tecnológico do século XX. As explosões lançaram na atmosfera diversos elementos radioativos. Hoje, uma em cada cinco pessoas nas fronteiras da Bielorússia vive em território contaminado. Em consequência da ação constante de pequenas doses de radiação, a cada ano, cresce no país o número de doentes de câncer, de deficientes mentais, de pessoas com disfunções neuropsicológicas e com mutações genéticas.
Numa fritadeira a ar com potência de 1400 W, um pedaço - UNICAMP 2020
Química - 2020Numa fritadeira a ar com potência de 1400 W, um pedaço de carne ficou pronto para ser consumido após 18 minutos de funcionamento do equipamento. Um cozimento semelhante foi realizado em menor tempo em um fogão a gás. Nesse caso, foram consumidos 16 gramas de gás propano, cuja reação de combustão é dada por:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g);
ΔH= –2046 kJ mol–1.
A classificação periódica encontra-se no final do caderno - FGV 2019
Química - 2019As rochas calcárias mais comercializadas no mundo apresentam os minerais calcita e dolomita, que contêm carbonato de cálcio (CaCO3) e carbonato de magnésio (MgCO3). Um outro mineral associado a essas rochas é a ankerita, que é um carbonato misto que apresenta os cátions dos elementos cálcio, magnésio e ferro, Ca2MgFe(CO3)4.
Na reação de aluminotermia com obtenção da liga de nióbio e - FGV 2019
Química - 2019O nióbio é um metal de grande importância tecnológica e as suas principais reservas mundiais se localizam no Brasil, na forma do minério pirocloro, constituído de Nb2O5. Em um dos processos de sua metalurgia extrativa, em prega-se a aluminotermia na presença do óxido Fe2O3, resultando numa liga de nióbio e ferro e óxido de alu mínio como subproduto. A reação desse processo é representada na equação:
3 Nb2O5 + Fe2O3 + 12 Al → 6 Nb + 2 Fe + 6 Al 2O3
Na natureza, o nióbio se apresenta na forma do isótopo estável nióbio-93, porém são conhecidos diversos isótopos sintéticos instáveis, que decaem por emissão de radiação. Um deles é o nióbio-95 que decai para o elemento molibdênio-95.
(Sistemas.dnpm.gov.br ; Tecnol. Metal. Mater. Miner., São Paulo, v. 6, n. 4, p. 185-191, abr.-jun. 2010 e G. Audi et al./ Nuclear Physics A 729 (2003) 3–128. Adaptado)
Em uma operação de aluminotermia para produção de liga de - FGV 2019
Química - 2019O nióbio é um metal de grande importância tecnológica e as suas principais reservas mundiais se localizam no Brasil, na forma do minério pirocloro, constituído de Nb2O5. Em um dos processos de sua metalurgia extrativa, em prega-se a aluminotermia na presença do óxido Fe2O3, resultando numa liga de nióbio e ferro e óxido de alu mínio como subproduto. A reação desse processo é representada na equação:
3 Nb2O5 + Fe2O3 + 12 Al → 6 Nb + 2 Fe + 6 Al 2O3
Na natureza, o nióbio se apresenta na forma do isótopo estável nióbio-93, porém são conhecidos diversos isótopos sintéticos instáveis, que decaem por emissão de radiação. Um deles é o nióbio-95 que decai para o elemento molibdênio-95.
(Sistemas.dnpm.gov.br ; Tecnol. Metal. Mater. Miner., São Paulo, v. 6, n. 4, p. 185-191, abr.-jun. 2010 e G. Audi et al./ Nuclear Physics A 729 (2003) 3–128. Adaptado)
A figura apresenta a curva de decaimento radiativo de uma - FGV 2019
Química - 2019A figura apresenta a curva de decaimento radiativo de uma amostra de nióbio-95, que decai para molibdênio95.
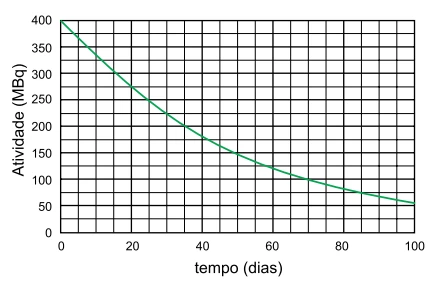
No processo de decaimento do radioisótopo nióbio-95, o tempo decorrido para que a atividade dessa amostra decaia para 25 MBq e o nome das espécies emitidas são
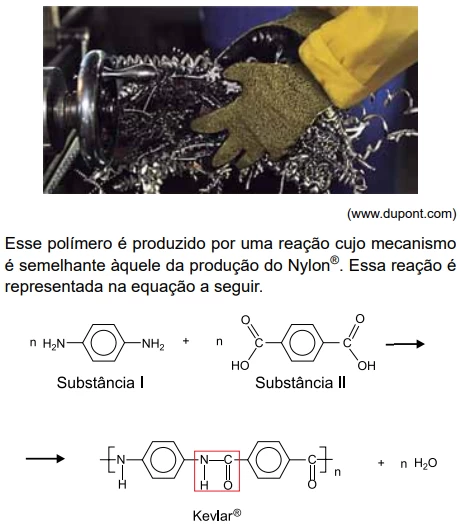
Operadores de máquinas e trabalhadores que manipulam lâmina - FGV 2019
Química - 2019Operadores de máquinas e trabalhadores que manipulam lâminas metálicas cortantes ou vidro precisam de equipamento de proteção adequado para as mãos. Para essa finalidade, existem luvas fabricadas com o polímero sintético denominado Kevlar®, que tem resistência mecânica semelhante à do aço.
A azida de sódio, NaN3, é uma substância empregada em - FGV 2019
Química - 2019A azida de sódio, NaN3, é uma substância empregada em diversos processos industriais e para propósitos militares na fabricação de explosivos. Quando dissolvida em água, ela se converte em ácido hidrazoico, HN3, que é um ácido fraco, volátil e muito tóxico para o ser humano.
NaN3(aq) + H2O (l) ←→ HN3 (aq) + NaOH (aq)
Uma solução aquosa a 25°C apresenta concentração de ácido - FGV 2019
Química - 2019A mandioca contém linamarina em todas as partes da planta. A decomposição da linamarina por enzimas produz o ácido cianídrico (HCN), que é um ácido fraco com constante de ionização (Ka) igual a 5 × 10–10 a 25°C. A fabricação de farinha da mandioca é feita com a prensagem da massa obtida por meio da ralação das raízes descascadas. A água resultante desse processo arrasta a linamarina e os seus produtos de decomposição, podendo causar contaminação do meio ambiente e intoxicação em animais e plantas.
(OLIVEIRA, Suzy Sarzi. Metabolismo da linamarina em reator de digestão anaeróbia com separação de fases. 2003. xiv, 88 f. Tese (doutorado) – Universidade Estadual Paulista, Faculdade de Ciências Agronômicas, 2003. Disponível em:
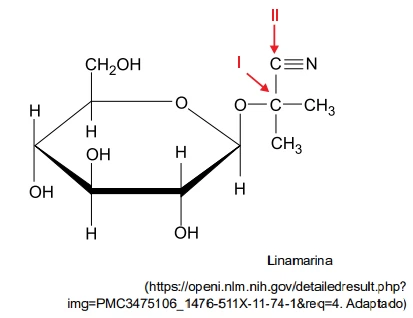
Sobre o tipo de ligação dos átomos de carbono na molécula - FGV 2019
Química - 2019A mandioca contém linamarina em todas as partes da planta. A decomposição da linamarina por enzimas produz o ácido cianídrico (HCN), que é um ácido fraco com constante de ionização (Ka) igual a 5 × 10–10 a 25°C. A fabricação de farinha da mandioca é feita com a prensagem da massa obtida por meio da ralação das raízes descascadas. A água resultante desse processo arrasta a linamarina e os seus produtos de decomposição, podendo causar contaminação do meio ambiente e intoxicação em animais e plantas.
(OLIVEIRA, Suzy Sarzi. Metabolismo da linamarina em reator de digestão anaeróbia com separação de fases. 2003. xiv, 88 f. Tese (doutorado) – Universidade Estadual Paulista, Faculdade de Ciências Agronômicas, 2003. Disponível em:

Em condições adequadas, a combustão da amônia resulta em - FGV 2019
Química - 2019Em condições adequadas, a combustão da amônia resulta em substâncias que não prejudicam o meio ambiente.
4 NH3 (g) + 3 O2(g) → 2 N2 (g) + 6 H2O (g)
Considere as seguintes equações termoquímicas envolvendo a amônia:
4 NH3 (g) + 7 O2(g) → 4 NO2(g) + 6 H2O(g)
ΔH0 = – 1132 kJ
6 NO2 (g) + 8 NH3 (g) → 7 N2(g) + 12 H2O(g)
ΔH0 = – 2740 kJ
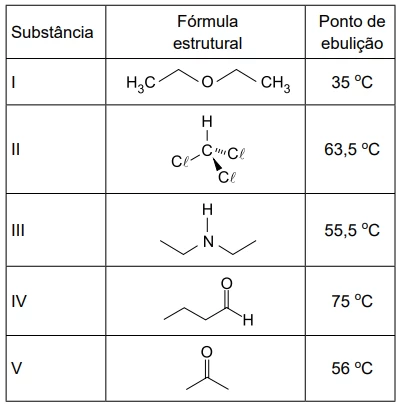
Em um experimento em laboratório de pesquisa, cinco amostra - FGV 2019
Química - 2019Considere as substâncias e seus dados apresentados na tabela a seguir.
Um aluno de química analisou o rótulo de um produto - FGV 2019
Química - 2019Um aluno de química analisou o rótulo de um produto empregado na agricultura para estimular a produção de frutos e descreveu seus constituintes com base na classificação periódica, conforme apresentado a seguir:
I. elemento do grupo 15, pertencente ao 3.o período;
II. elemento do quarto período que apresenta o menor valor de energia de ionização;
III. elemento do segundo período que apresenta 3 elétrons na camada de valência.
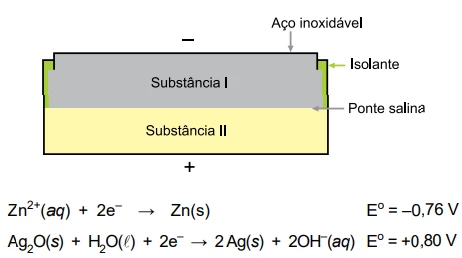
Certas pilhas em formato de moeda ou botão, que são usadas - FGV 2019
Química - 2019Certas pilhas em formato de moeda ou botão, que são usadas em relógios de pulso e em pequenos aparelhos eletrônicos, empregam os metais zinco e prata em seu interior. Uma delas é representada no esquema da figura a seguir, e os potenciais padrão de redução são fornecidos para reações envolvendo os seus componentes.
A reação química da produção da fosfina pode ser - FATEC 2019
Química - 2019Um incêndio atingiu uma fábrica de resíduos industriais em Itapevi, na Grande São Paulo. O local armazenava três toneladas de fosfeto de alumínio (AlP). De acordo com a Companhia Ambiental do Estado de São Paulo (Cetesb), o fosfeto de alumínio reagiu com a água usada para apagar as chamas, produzindo hidróxido de alumínio e fosfina (PH3).
A fosfina é um gás tóxico, incolor, e não reage com a água, porém reage rapidamente com o oxigênio liberando calor e produzindo pentóxido de difósforo (P2O5). Segundo os médicos, a inalação do P2O5 pode causar queimadura tanto na pele quanto nas vias respiratórias devido à formação de ácido fosfórico.
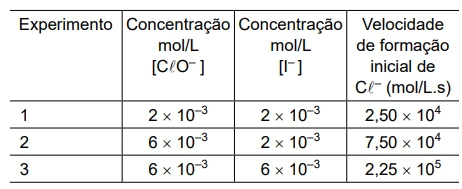
A reação do íon iodeto, I–, com o íon hipoclorito, ClO–, - FGV 2019
Química - 2019A reação do íon iodeto, I– , com o íon hipoclorito, ClO– , presente no princípio ativo da água sanitária usada como desinfetante doméstico, ocorre com a formação dos íons cloreto, Cl– , e hipoiodito, IO– , de acordo com a equação
ClO– (aq) + I– (aq) → IO– (aq) + Cl– (aq)
Um estudo cinético para avaliar a velocidade dessa reação foi realizado com três experimentos, e seus dados são mostrados na tabela:
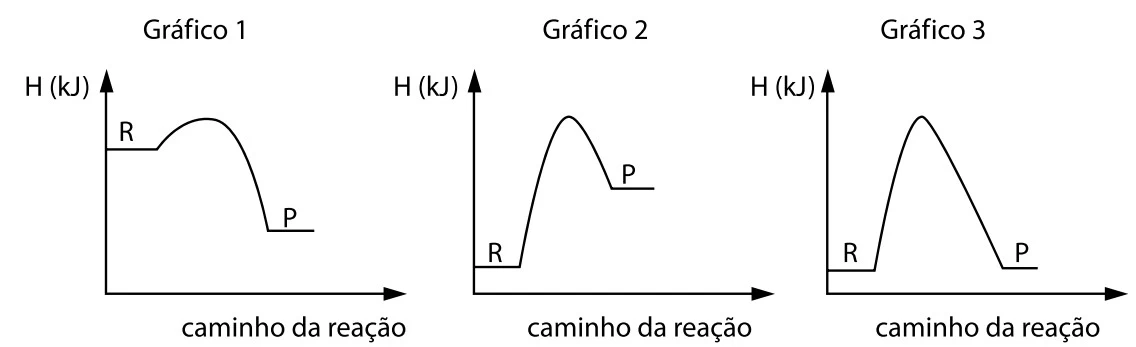
Os gráficos 1,2 e 3 representam a variação da energia em - FATEC 2019
Química - 2019Um incêndio atingiu uma fábrica de resíduos industriais em Itapevi, na Grande São Paulo. O local armazenava três toneladas de fosfeto de alumínio (AlP). De acordo com a Companhia Ambiental do Estado de São Paulo (Cetesb), o fosfeto de alumínio reagiu com a água usada para apagar as chamas, produzindo hidróxido de alumínio e fosfina (PH3).
A fosfina é um gás tóxico, incolor, e não reage com a água, porém reage rapidamente com o oxigênio liberando calor e produzindo pentóxido de difósforo (P2O5). Segundo os médicos, a inalação do P2O5 pode causar queimadura tanto na pele quanto nas vias respiratórias devido à formação de ácido fosfórico.
https://tinyurl.com/yafzufbo Acesso em: 11.10.18. Adaptado.
Os gráficos 1,2 e 3 representam a variação da energia em função do caminho da reação para três transformações químicas, sendo R o reagente e P o produto de cada reação.
Uma solução de glicose, C6H12O6, foi preparada para ser - FGV 2019
Química - 2019Uma solução de glicose, C6H12O6, foi preparada para ser empregada como padrão em uma análise de laboratório. Foram adicionadas 450 mg de glicose em um balão volumétrico com capacidade de 250 mL e foi adicionada água destilada até o traço de aferição do balão.
Uma das substâncias que pode neutralizar o ácido - FATEC 2019
Química - 2019Uma das substâncias que pode neutralizar o ácido fosfórico é o hidróxido de magnésio, Mg(OH)2.
Nos meses de verão, os países do sul da Europa apresentam - FGV 2019
Química - 2019Nos meses de verão, os países do sul da Europa apresentam temperaturas muito elevadas. No mês de julho de 2013, a temperatura no interior de Portugal atingiu o valor mais alto já registrado no país, 47°C.
A reação que ocorre entre a fosfina e o oxigênio é - FATEC 2019
Química - 2019A reação que ocorre entre a fosfina e o oxigênio é representada pela equação química
2 PH3 (g) + 4 O2 (g) → P2O5 (g) + 3 H2O (g)
A amônia (NH3), molécula de estrutura semelhante à da - FATEC 2019
Química - 2019A amônia (NH3), molécula de estrutura semelhante à da fosfina, reage com água produzindo uma solução de caráter básico. A reação que ocorre pode ser representada pela equação química
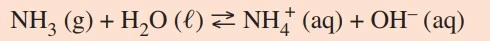
O processo de acidificação do solo é predominante em - UNESP 2019
Química - 2019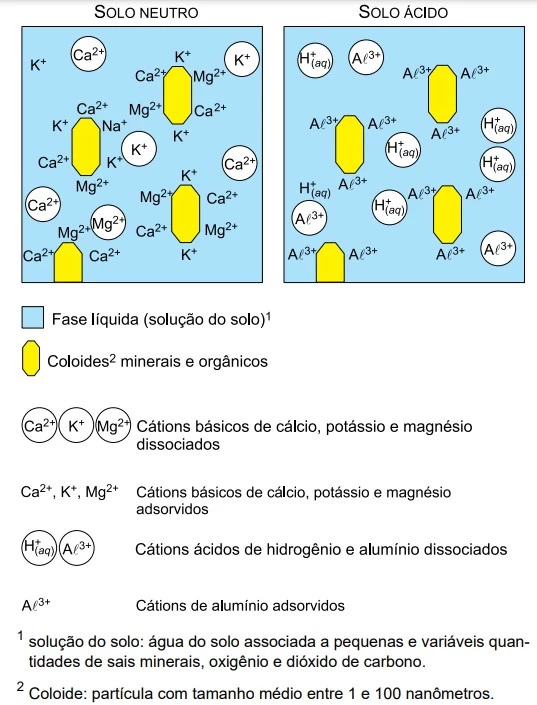
Se nos coloides do solo predominarem os cátions básicos, a solução do solo terá um pH próximo ao neutro. Se, ao contrário, ali predominarem o hidrogênio e o alumínio, na solução do solo também predominarão esses cátions, tornando-a ácida.
Leia o excerto e analise as três afirmações a seguir. - UNESP 2019
Química - 2019Leia o excerto e analise as três afirmações a seguir.
Todas as moléculas de uma parcela de ar contribuem para a pressão atmosférica. Como o vapor d’água é um gás, ele também contribui com um valor de pressão parcial, conhecido como pressão de vapor (e), aumentando ou diminuindo a pressão atmosférica. Quando a pressão de vapor (e) atinge seu valor máximo possível para uma determinada temperatura do ar, diz-se que o ar está saturado de umidade ou, em outras palavras, que o ar está cheio de vapor. Tem-se, portanto, a pressão de vapor de saturação (es). A umidade relativa é a razão entre a pressão de vapor (e) e a pressão de vapor de saturação (es).
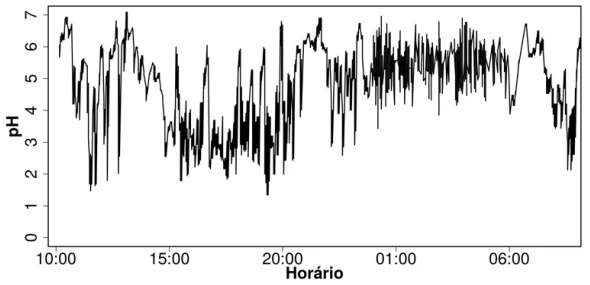
O refluxo gastroesofágico é o retorno do conteúdo - UNICAMP 2019
Química - 2019O refluxo gastroesofágico é o retorno do conteúdo do estômago para o esôfago, em direção à boca, podendo causar dor e inflamação. A pHmetria esofágica de longa duração é um dos exames que permitem avaliar essa doença, baseando-se em um resultado como o que é mostrado a seguir.
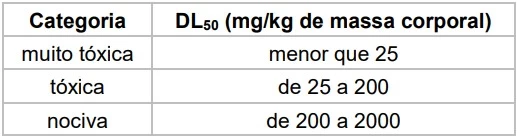
Dois estudantes, de massa corporal em torno de 75 kg - UNICAMP 2019
Química - 2019Dois estudantes, de massa corporal em torno de 75 kg, da Universidade de Northumbria, no Reino Unido, quase morreram ao participar de um experimento científico no qual seriam submetidos a determinada dose de cafeína e a um teste físico posterior. Por um erro técnico, ambos receberam uma dose de cafeína 100 vezes maior que a dose planejada. A dose planejada era de 0,3 g de cafeína, equivalente a três xícaras de café. Sabe-se que a União Europeia, onde o teste ocorreu, classifica a toxicidade de uma dada substância conforme tabela a seguir.
Fake News ou não? Hoje em dia, a disponibilidade de - UNICAMP 2019
Química - 2019Fake News ou não? Hoje em dia, a disponibilidade de informações é muito grande, mas precisamos saber interpretá-las corretamente. Um artigo na internet tem o seguinte título: “Glutamato monossódico, o sabor que mata!”. Em determinado ponto do texto, afirma-se:
“Só para você ter ideia dos riscos, organizações internacionais de saúde indicam que a ingestão diária de sódio para cada pessoa seja de 2,3 gramas. O glutamato é composto por 21% de sódio e, com certeza, não será o único tempero a ser acrescentado ao seu almoço ou jantar. Além disso, o realçador (glutamato) só conta um terço do nutriente que é encontrado no sal de cozinha.”
Dados de massas molares em g . mol–1: sódio = 23, cloreto = 35,5, glutamato monossódico = 169.
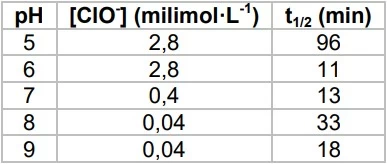
De tempos em tempos, o mundo se choca com notícias sobre -UNICAMP 2019
Química - 2019De tempos em tempos, o mundo se choca com notícias sobre o uso de armas químicas em conflitos. O sarin é um composto organofosforado líquido, insípido, incolor e inodoro, altamente volátil, que se transforma em gás quando exposto ao ar, sendo um dos principais alvos dessas notícias. Em 1955, um projeto confidencial do exército americano estudou a eficiência de hipoclorito na eliminação de sarin em ambientes contaminados. A tabela a seguir mostra alguns resultados obtidos nesse estudo.
A adição de biodiesel ao diesel tradicional é uma - UNICAMP 2019
Química - 2019A adição de biodiesel ao diesel tradicional é uma medida voltada para a diminuição das emissões de gases poluentes. Segundo um estudo da FIPE, graças a um aumento no uso de biodiesel no Brasil, entre 2008 e 2011, evitou-se a emissão de 11 milhões de toneladas de CO2 (gás carbônico).
Dados de massas molares em g . mol–1: H = 1, C = 12, O = 16.
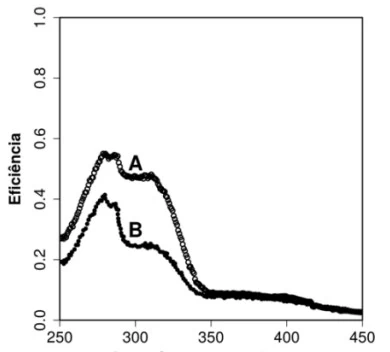
Em um estudo científico, uma fina camada de um novo - UNICAMP 2019
Química - 2019Em um estudo científico, uma fina camada de um novo filtro protetor solar foi exposta previamente à radiação UVA e UVB durante diferentes intervalos de tempo, testando-se em seguida a sua eficiência em barrar essa mesma radiação. A figura a seguir mostra apenas dois dos resultados obtidos no experimento, sendo uma das curvas referente a uma exposição por 10 minutos e, a outra, a uma exposição de 30 minutos.
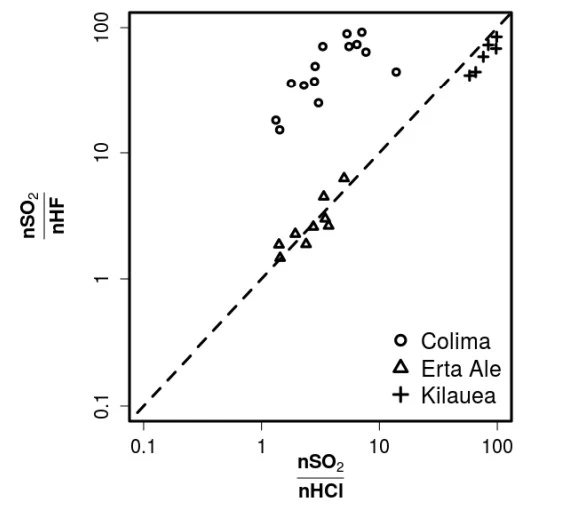
Episódios recentes de erupções vulcânicas têm trazido - UNICAMP 2019
Química - 2019Episódios recentes de erupções vulcânicas têm trazido consequências trágicas para a sociedade e para o meio ambiente. Ativo desde 1983, o Vulcão Kilauea apresentou, em 2018, a sua maior erupção já registrada. Quase ao mesmo tempo, foi a vez do Vulcão Fuego da Guatemala mostrar sua força. No Kilauea não houve explosões, ao contrário do que ocorreu no Fuego. Os especialistas afirmam que a ocorrência de uma erupção explosiva depende da concentração e do tipo de gases dissolvidos no magma, como SO2, HF e HCl, além de vapor de água e CO2 aprisionados. A figura a seguir dá informações sobre a relação entre quantidades (em mol) de SO2, HF e HCl no magma de três vulcões distintos.
Recentemente, o FDA aprovou nos EUA a primeira terapia - UNICAMP 2019
Química - 2019Recentemente, o FDA aprovou nos EUA a primeira terapia para o tratamento da fenilcetonúria, doença que pode ser identificada pelo teste do pezinho. Resumidamente, a doença leva ao acúmulo de fenilalanina no corpo, já que ela deixa de ser transformada em tirosina, em função da deficiência da enzima fenilalanina hidroxilase (PAH). As curvas do gráfico a seguir podem representar o processo metabólico da conversão de fenilalanina em tirosina em dois indivíduos: um normal e outro que apresenta a fenilcetonúria.

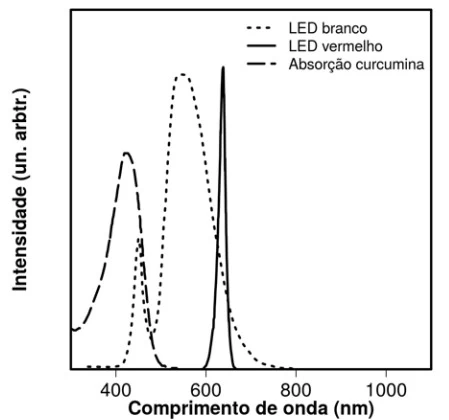
Pesquisas mostram que a curcumina — substância extraída - UNICAMP 2019
Química - 2019Pesquisas mostram que a curcumina — substância extraída da cúrcuma — pode ser usada como fotossensibilizador na terapia fotodinâmica (TFD). Nessa técnica, se houver absorção de luz pelo fotossensibilizador, que está na célula, ocorre reação com o oxigênio molecular gerando espécies químicas citotóxicas, que promovem a oxidação de lipídios, aminoácidos e proteínas, levando à morte celular. Deste modo, a TFD pode ser usada para o tratamento de câncer, lesões pré-malignas, etc. O gráfico a seguir mostra a intensidade de absorção de luz pela curcumina e a intensidade de emissão de luz de dois LEDs, um vermelho e um branco, em função do comprimento de onda da luz.
O gráfico mostra o tempo decorrido desde que um Boeing - UNESP 2019
Química - 2019Leia o texto para responder às questões 72 e 73.

Tomando como base um Boeing 737-800, seus tanques de combustível podem comportar até 21 t (21 toneladas) de querosene de aviação (QAV).
O consumo do QAV tem como principal variável o peso total da aeronave. Além disso, altitude, velocidade e temperatura também influenciam na conta. Quanto mais longo o percurso, mais eficiente a aeronave será, pois o consumo do QAV em altitude é muito menor, devido à atmosfera mais rarefeita, que causa menos resistência ao avanço e, ao mesmo tempo em que ocorre o consumo, reduz-se o peso da aeronave.
Em voo de cruzeiro (quando o avião alcança a velocidade e altitude ideais) o consumo de QAV é de aproximadamente 2 200 kg/h. A fase do voo com maior consumo de combustível é a subida, pois a aeronave precisa de muita força para decolar e ganhar altitude. O consumo de QAV chega a ser o dobro, se comparado ao voo de cruzeiro. Já na descida, o consumo é menor, chegando a ser 1/3 em comparação ao voo de cruzeiro.
Voando na altitude de cruzeiro com uma velocidade média - UNESP 2019
Química - 2019Leia o texto para responder às questões 72 e 73.

Tomando como base um Boeing 737-800, seus tanques de combustível podem comportar até 21 t (21 toneladas) de querosene de aviação (QAV).
O consumo do QAV tem como principal variável o peso total da aeronave. Além disso, altitude, velocidade e temperatura também influenciam na conta. Quanto mais longo o percurso, mais eficiente a aeronave será, pois o consumo do QAV em altitude é muito menor, devido à atmosfera mais rarefeita, que causa menos resistência ao avanço e, ao mesmo tempo em que ocorre o consumo, reduz-se o peso da aeronave.
Em voo de cruzeiro (quando o avião alcança a velocidade e altitude ideais) o consumo de QAV é de aproximadamente 2 200 kg/h. A fase do voo com maior consumo de combustível é a subida, pois a aeronave precisa de muita força para decolar e ganhar altitude. O consumo de QAV chega a ser o dobro, se comparado ao voo de cruzeiro. Já na descida, o consumo é menor, chegando a ser 1/3 em comparação ao voo de cruzeiro.
A energia emitida pelo Sol é o resultado de diferentes - UNESP 2019
Química - 2019A energia emitida pelo Sol é o resultado de diferentes fusões nucleares que ocorrem nesse astro. Algumas reações nucleares que ocorrem no Sol são:
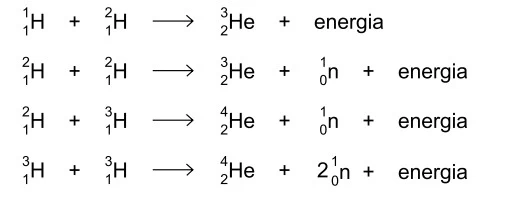
Estima-se que, a cada segundo, 657 milhões de toneladas de hidrogênio estejam produzindo 653 milhões de toneladas de hélio. Supõe-se que a diferença, 4 milhões de toneladas, equivalha à energia liberada e enviada para o espaço.
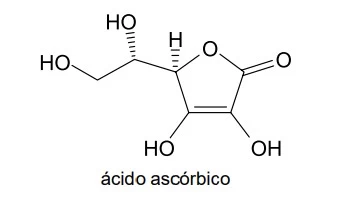
Considere a fórmula estrutural do ácido ascórbico - UNESP 2019
Química - 2019Considere a fórmula estrutural do ácido ascórbico (vitamina C).
Os gráficos mostram o resultado de um experimento de - UNESP 2019
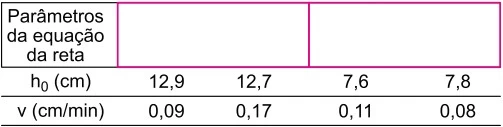
Química - 2019Os gráficos mostram o resultado de um experimento de queima de quatro velas de uso comercial, sendo duas do tipo A e duas do tipo B. Tal experimento foi feito para determinar a velocidade de queima das velas A e B em ambientes ventilado e não ventilado.
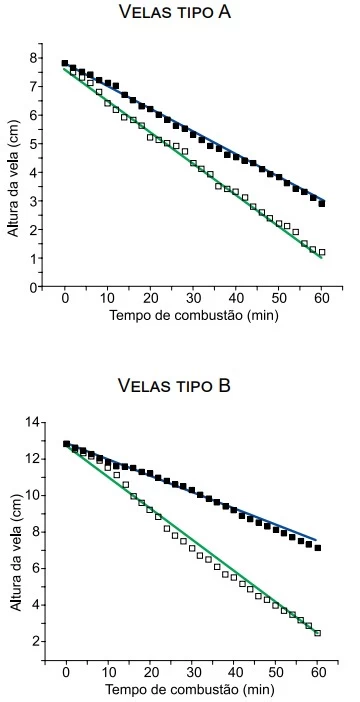
Sendo h0 a altura inicial e v a velocidade de queima de cada vela, os dados obtidos no experimento foram organizados na tabela:
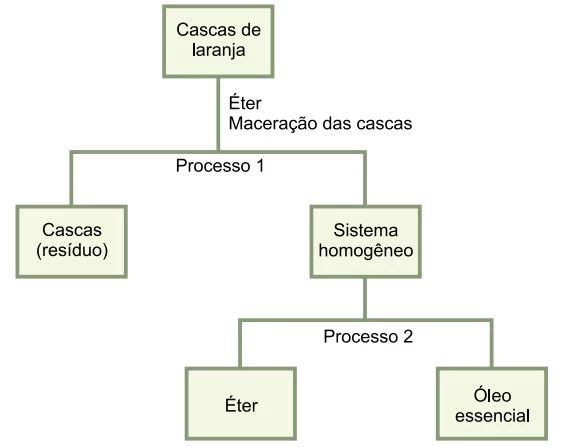
O esquema a seguir representa o processo de extração do - FAMERP 2019
Química - 2019O esquema a seguir representa o processo de extração do óleo essencial de cascas de laranja.
Em janeiro de 2018 foi encontrado em uma mina na África - FAMERP 2019
Química - 2019Em janeiro de 2018 foi encontrado em uma mina na África o quinto maior diamante (uma variedade alotrópica do carbono) do mundo, pesando 900 quilates.
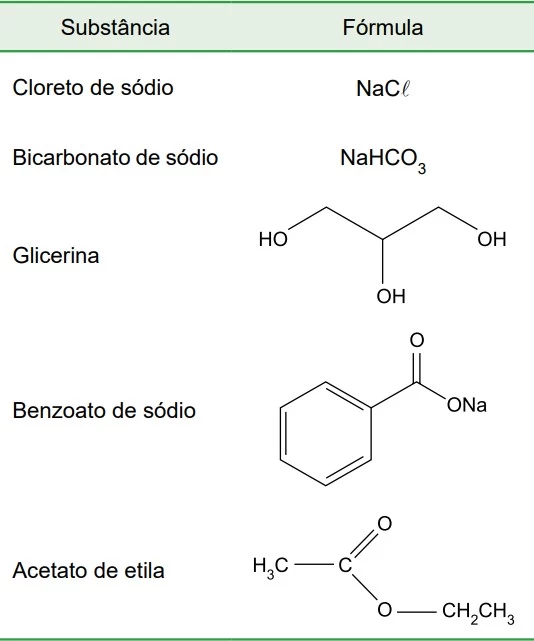
Umectantes são substâncias que apresentam grande - FAMERP 2019
Química - 2019Umectantes são substâncias que apresentam grande afinidade por moléculas de água e, por isso, têm a propriedade de manter a umidade dos materiais, sendo adicionados a bolos, bolachas, panetones e outros alimentos. A tabela a seguir apresenta algumas substâncias utilizadas na preparação de alimentos.
Filtros contendo óxido de cálcio são utilizados no - FAMERP 2019
Química - 2019Filtros contendo óxido de cálcio são utilizados no tratamento de biogás, removendo dele gases prejudiciais ao meio ambiente.
Em águas naturais, a acidez mineral pode ser formada - FAMERP 2019
Química - 2019Em águas naturais, a acidez mineral pode ser formada através da oxidação de sulfetos, como indica a equação química a seguir:

A combinação dos elementos Ca e Br forma uma substância - FAMERP 2019
Química - 2019A combinação dos elementos Ca e Br forma uma substância solúvel em água, de fórmula _________. Uma solução aquosa dessa substância é classificada como ____________ de eletricidade.
O hipoclorito de sódio é utilizado na desinfecção da - FAMERP 2019
Química - 2019O hipoclorito de sódio é utilizado na desinfecção da água para o consumo humano devido à ação oxidante do íon ClO–. No entanto, esse sal sofre hidrólise de acordo com a seguinte sequência de reações:
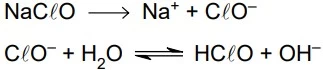
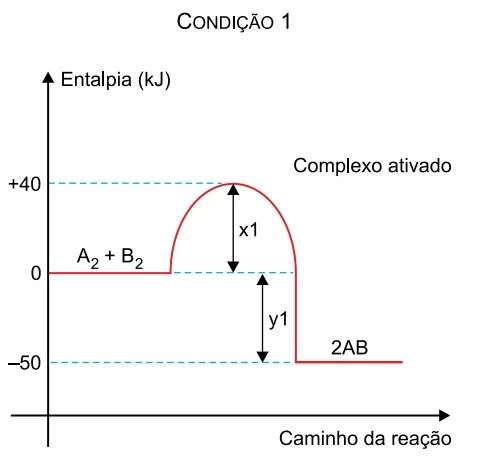
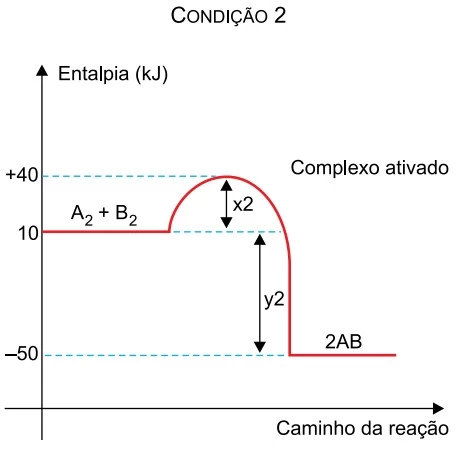
Os gráficos apresentam dados cinéticos de uma mesma - FAMERP 2019
Química - 2019Os gráficos apresentam dados cinéticos de uma mesma reação realizada sob duas condições diferentes.
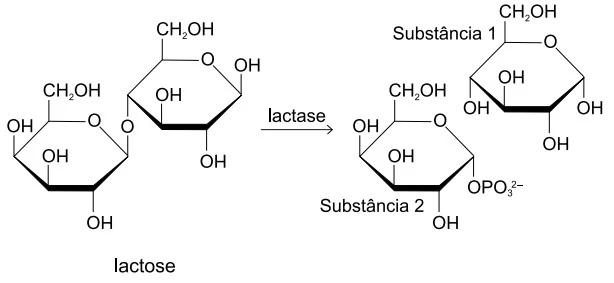
A remoção da lactose de leite e derivados, necessária - FAMERP 2019
Química - 2019A remoção da lactose de leite e derivados, necessária para que pessoas com intolerância a essa substância possam consumir esses produtos, é feita pela adição da enzima lactase no leite, que quebra a molécula de lactose, formando duas moléculas menores, conforme a equação:
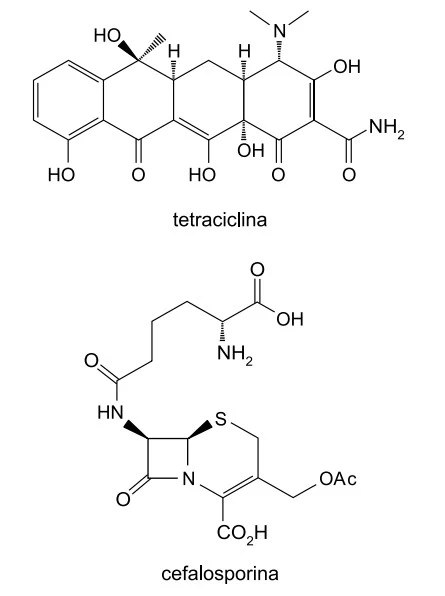
Tetraciclina e cefalosporina são antibióticos clássicos - FAMERP 2019
Química - 2019Tetraciclina e cefalosporina são antibióticos clássicos, cujas fórmulas estruturais estão representadas a seguir.
A reação de água com ácido clorídrico produz o ânion - FUVEST 2019
Química - 2019A reação de água com ácido clorídrico produz o ânion cloreto e o cátion hidrônio. A estrutura que representa corretamente o cátion hidrônio é
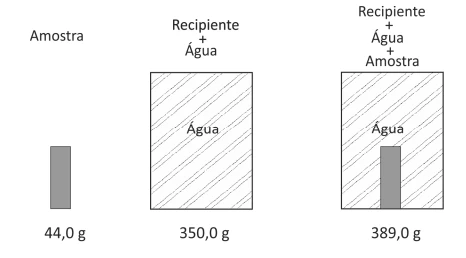
Uma amostra sólida, sem cavidades ou poros, poderia ser - FUVEST 2019
Química - 2019Uma amostra sólida, sem cavidades ou poros, poderia ser constituída por um dos seguintes materiais metálicos: alumínio, bronze, chumbo, ferro ou titânio. Para identificá-la, utilizou-se uma balança, um recipiente de volume constante e água. Efetuaram-se as seguintes operações: 1) pesou-se a amostra; 2) pesou-se o recipiente completamente cheio de água; 3) colocou-se a amostra no recipiente vazio, completando seu volume com água e determinou-se a massa desse conjunto. Os resultados obtidos foram os seguintes:

Um antiácido comercial em pastilhas possui, em sua - FUVEST 2019
Química - 2019Um antiácido comercial em pastilhas possui, em sua composição, entre outras substâncias, bicarbonato de sódio, carbonato de sódio e ácido cítrico. Ao ser colocada em água, a pastilha dissolve-se completamente e libera gás carbônico, o que causa a efervescência. Para entender a influência de alguns fatores sobre a velocidade de dissolução da pastilha, adicionou-se uma pastilha a cada um dos quatro recipientes descritos na tabela, medindo-se o tempo até a sua dissolução completa.

Considerando que baterias de Li-FeS2 podem gerar uma - FUVEST 2019
Química - 2019Considerando que baterias de Li-FeS2 podem gerar uma voltagem nominal de 1,5 V, o que as torna úteis no cotidiano e que a primeira reação de descarga dessas baterias é 2 Li + FeS2 → Li2FeS2, é correto afirmar:
Peptídeos podem ser analisados pelo tratamento com duas - FUVEST 2019
Química - 2019Peptídeos podem ser analisados pelo tratamento com duas enzimas. Uma delas, uma carboxipeptidase, quebra mais rapidamente a ligação peptídica entre o aminoácido que tem um grupo carboxílico livre e o seguinte. O tratamento com outra enzima, uma aminopeptidase, quebra, mais rapidamente, a ligação peptídica entre o aminoácido que tem um grupo amino livre e o anterior. Isso permite identificar a sequência dos aminoácidos no peptídeo. Um tripeptídeo, formado pelos aminoácidos lisina, fenilalanina e glicina, não necessariamente nessa ordem, foi submetido a tratamento com carboxipeptidase, resultando em uma mistura de um dipeptídeo e fenilalanina. O tratamento do mesmo tripeptídeo com aminopeptidase resultou em uma mistura de um outro dipeptídeo e glicina.
O número de combinações possíveis para os três aminoácidos e a fórmula estrutural do peptídeo podem ser, respectivamente,
Em um experimento, determinadas massas de ácido maleico - FUVEST 2019
Química - 2019Em um experimento, determinadas massas de ácido maleico e acetona foram misturadas a 0 °C, preparando-se duas misturas idênticas. Uma delas (X) foi resfriada a -78 °C, enquanto a outra (M) foi mantida a 0 °C. A seguir, ambas as misturas (M e X) foram filtradas, resultando nas misturas N e Y. Finalmente, um dos componentes de cada mistura foi totalmente retirado por destilação. Os recipientes (marcados pelas letras O e Z) representam o que restou de cada mistura após a destilação.
Nas figuras, as moléculas de cada componente estão representadas por retângulos ou triângulos.
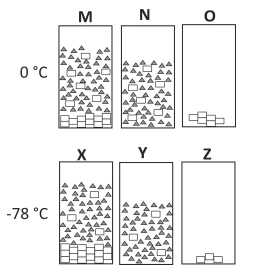
Tanto no recipiente M como no recipiente X, estão representadas soluções ___I___ de ___II___, cuja solubilidade ___III___ com a diminuição da temperatura. A uma determinada temperatura, as concentrações em M e N e em X e Y são ___IV___. Em diferentes instantes, as moléculas representadas por um retângulo pertencem a um composto que pode estar ___V___ ou no estado ___VI___.
O gráfico a seguir indica a temperatura de ebulição de - FUVEST 2019
Química - 2019O gráfico a seguir indica a temperatura de ebulição de bromoalcanos (CnH2n+1Br) para diferentes tamanhos de cadeia carbônica.
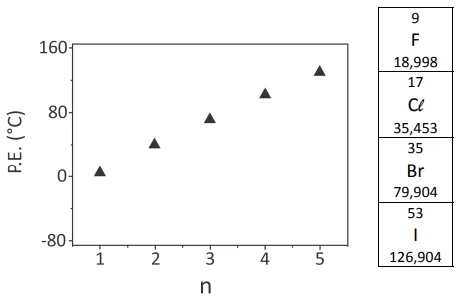
Considerando as propriedades periódicas dos halogênios, a alternativa que descreve adequadamente o comportamento expresso no gráfico de temperaturas de ebulição versus tamanho de cadeia carbônica para CnH2n+1F ([]) e CnH2n+1I (•) é:
O cinamaldeído é um dos principais compostos que dão o - FUVEST 2019
Química - 2019O cinamaldeído é um dos principais compostos que dão o sabor e o aroma da canela. Quando exposto ao ar, oxida conforme a equação balanceada:
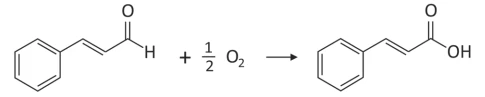
Uma postagem de humor na internet trazia como título - FUVEST 2019
Química - 2019Uma postagem de humor na internet trazia como título “Provas de que gatos são líquidos” e usava, como essas provas, fotos reais de gatos, como as reproduzidas aqui.

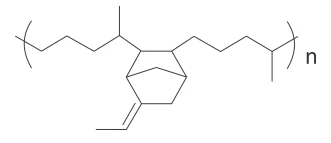
A bola de futebol que foi utilizada na Copa de 2018 foi - FUVEST 2019
Química - 2019A bola de futebol que foi utilizada na Copa de 2018 foi chamada Telstar 18. Essa bola contém uma camada interna de borracha que pertence a uma classe de polímeros genericamente chamada de EPDM. A fórmula estrutural de um exemplo desses polímeros é
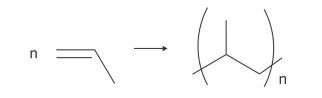
Polímeros podem ser produzidos pela polimerização de compostos insaturados (monômeros) como exemplificado para o polipropileno (um homopolímero):
Um grão de milho de pipoca, visto a olho nu, apresenta - FUVEST 2019
Química - 2019Um grão de milho de pipoca, visto a olho nu, apresenta duas regiões distintas, representadas por A e B na figura. Em A, ocorre o tecido acumulador de amido, usado, pela planta, para nutrir o embrião. Em B, os tecidos vegetais possuem maior teor de água.

Em uma família, o número de irmãs de cada filha é igual - FUVEST 2019
Química - 2019Em uma família, o número de irmãs de cada filha é igual à metade do número de irmãos. Cada filho tem o mesmo número de irmãos e irmãs.
O número total de filhos e filhas da família é
A produção do aço ocorre nas usinas siderúrgicas em I - FATEC 2019/2
Química - 2019A produção do aço ocorre nas usinas siderúrgicas em I , e tem como principais matérias-primas minérios de II e III.
Hidrocarbonetos podem ser usados como combustível, por - FATEC 2019/2
Química - 2019Hidrocarbonetos podem ser usados como combustível, por exemplo o gás but-1-eno.
A escala de pH que varia de 0 a 14 é válida apenas para - FATEC 2019/2
Química - 2019A escala de pH que varia de 0 a 14 é válida apenas para sistemas aquosos a 25°C. Variando-se a temperatura, a escala de pH também varia.
O quadro fornece valores de Kw e de pH da água pura em diferentes temperaturas.
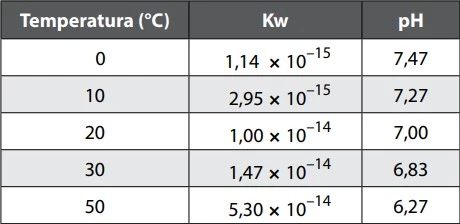
Examinando o quadro, identifique as duas substâncias - FATEC 2019/2
Química - 2019Em seu livro Tratado Elementar de Química, publicado em 1789, Antoine Lavoisier estabeleceu uma nova nomenclatura para diversas substâncias químicas. Alguns exemplos, extraídos desse livro, são dados no quadro.

A reação química que ocorre entre as substâncias - Fatec 2019/2
Química - 2019Em seu livro Tratado Elementar de Química, publicado em 1789, Antoine Lavoisier estabeleceu uma nova nomenclatura para diversas substâncias químicas. Alguns exemplos, extraídos desse livro, são dados no quadro.

Uma substância sólida cristalina em temperatura e pressão - FGV 2018
Química - 2018Uma substância sólida cristalina em temperatura e pressão ambiente foi submetida a alguns testes em laboratório químico. A substância se solubilizou em água, e a sua solução aquosa não conduziu corrente elétrica. Os testes de aquecimento para medida do seu ponto de fusão foram insatisfatórios, pois a substância, em recipiente aberto, fundiu e se transformou quimicamente, formando um resíduo sólido preto insolúvel em água.
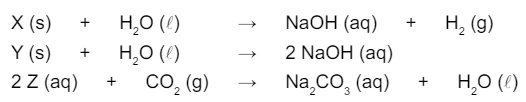
O elemento sódio combina-se com os elementos hidrogênio e - FGV 2018
Química - 2018O elemento sódio combina-se com os elementos hidrogênio e oxigênio, resultando em compostos químicos distintos. Três diferentes compostos de sódio foram submetidos a três processos químicos, representados nas equações:
O gráfico apresenta a variação da temperatura de uma substâ - FGV 2018
Química - 2018O gráfico apresenta a variação da temperatura de uma substância durante aquecimento sob pressão constante.
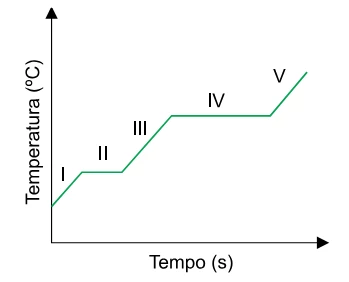
Os resultados das análises de pH a 20°C de amostras de duas - FGV 2018
Química - 2018Os resultados das análises de pH a 20°C de amostras de duas marcas brasileiras distintas de água mineral são indicados no quadro.

Considere também que essas duas amostras podem estar gaseificadas com CO2, cujo equilíbrio químico em meio aquoso é representado na equação
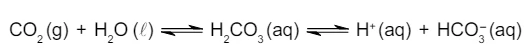
Foram preparadas quatro soluções aquosas saturadas a 60 °C, - FGV 2018
Química - 2018Foram preparadas quatro soluções aquosas saturadas a 60 °C, contendo cada uma delas 100 g de água e um dos sais: iodeto de potássio, KI, nitrato de potássio, KNO3, nitrato de sódio, NaNO3, e cloreto de sódio, NaCl.
Na figura, são representadas as curvas de solubilidade desses sais:
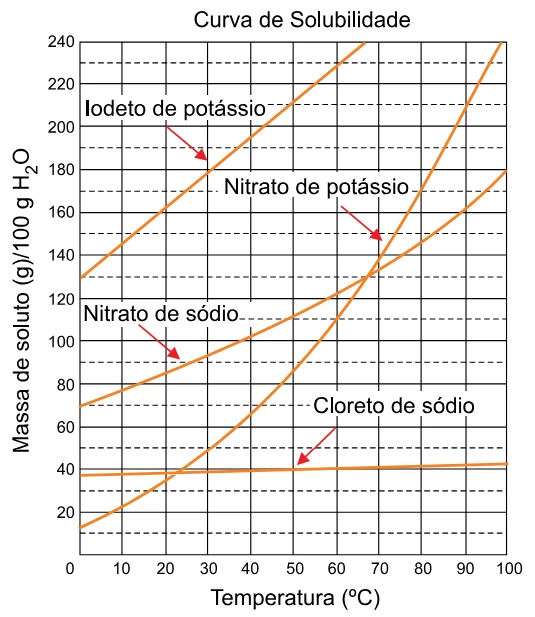
Uma bateria de recarga ultrarrápida foi desenvolvida por - FGV 2018
Química - 2018Uma bateria de recarga ultrarrápida foi desenvolvida por pesquisadores da Universidade Stanford. Ela emprega eletrodos de alumínio e de grafite; e, como eletrólito, um sal orgânico que é líquido na temperatura ambiente, cloreto de 1-etil-3-metilimidazolio, representado pela fórmula [EMIm]Cl.
Durante as reações, o alumínio metálico forma espécies complexas com o ânion cloreto, AlCl 4 – e Al 2Cl 7 – . Nos demais aspectos, a operação da bateria segue o comportamento usual de uma pilha.
Um esquema de sua operação é representado na figura.
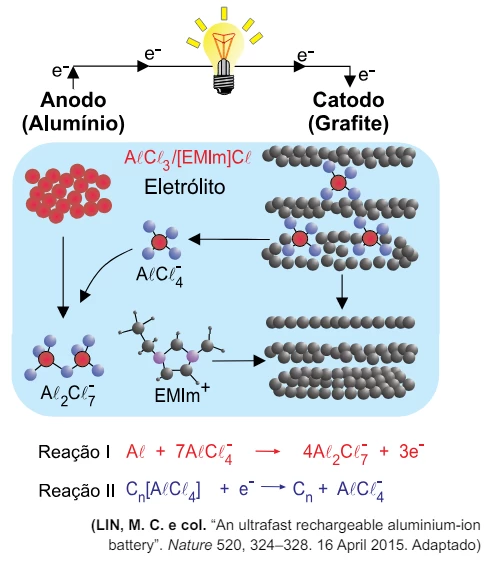
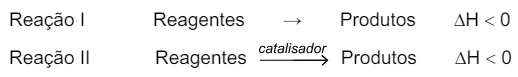
Em um experimento de química, são realizadas duas reações, - FGV 2018
Química - 2018Em um experimento de química, são realizadas duas reações, I e II, empregando-se os mesmos reagentes nas mesmas condições de temperatura e pressão. Essas reações ocorrem em uma única etapa.
O iodeto de hidrogênio, HI, é uma substância gasosa - FGV 2018
Química - 2018O iodeto de hidrogênio, HI, é uma substância gasosa empregada em sínteses orgânicas. Uma das rotas de obtenção do HI pode ser feita, em um sistema fechado, por meio da reação do hidrogênio e do iodo como representado na equação
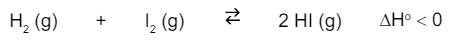
O sulfato de potássio, K2SO4, empregado na composição de - FGV 2018
Química - 2018O sulfato de potássio, K2SO4, empregado na composição de fertilizantes, pode ser produzido a partir da reação química representada na equação:

Uma resolução do Ministério da Saúde do Brasil regulamenta - FGV 2018
Química - 2018Uma resolução do Ministério da Saúde do Brasil regulamenta que o limite máximo da quantidade de ácido fosfórico, H3PO4, em bebidas refrigerantes é 0,07 g/100 mL. De acordo com essa regulamentação, a concentração máxima de ácido fosfórico, em mol/L, nos refrigerantes é,
Uma substância gasosa X, massa molar 32 g/mol, apresenta - FGV 2018
Química - 2018Uma substância gasosa X, massa molar 32 g/mol, apresenta densidade igual a 2,0 g/L a uma certa condição de temperatura e pressão. Nessas mesmas condições de temperatura e pressão, uma outra substância gasosa Y tem densidade igual a 3,0 g/L.
O radioisótopo tálio-204, 204Tl, decai por dois processos. - FGV 2018
Química - 2018O radioisótopo tálio-204, 204Tl, decai por dois processos. Pelo processo I, esse radioisótopo decai por emissão de radiação beta negativa. Pelo processo II, decai por captura eletrônica, em que um elétron da nuvem eletrônica do tálio-204 se combina com um próton de seu núcleo resultando em um nêutron.
Diante da crescente preocupação mundial com as mudanças - FGV 2018
Química - 2018Diante da crescente preocupação mundial com as mudanças do clima global — em especial o aquecimento do planeta —, as emissões de gases de efeito estufa se tornam uma questão cada vez mais relevante. Em comparação com o resto do mundo, o Brasil tem se destacado por apresentar reduzidos índices de emissão de gases em sua produção de energia, o que se deve basicamente à elevada participação de fontes renováveis na oferta energética interna.
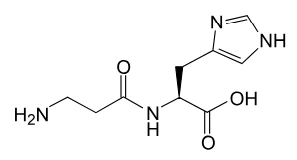
O dipeptídeo representado pela fórmula é uma substância - FGV 2018
Química - 2018O dipeptídeo representado pela fórmula
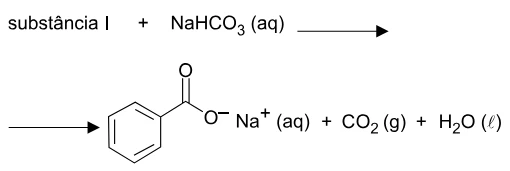
Na equação, representa-se a reação da interação da molécula - FGV 2018
Química - 2018Na equação, representa-se a reação da interação da molécula orgânica, substância I, com o hidrogenocarbonato de sódio em meio aquoso.
Leia o trecho do soneto “Como eu te amo”, de Gonçalves - FATEC 2018/2
Química - 2018Leia o trecho do soneto “Como eu te amo”, de Gonçalves Dias, para responder a questão.

Considere uma vela composta de um hidrocarboneto - FATEC 2018/2
Química - 2018Considere uma vela composta de um hidrocarboneto (fórmula molecular C22H46) cuja combustão completa libera apenas gás carbônico e água.
Entre os elementos citados, o único pertencente ao - FATEC 2018/2
Química - 2018Barcarena, no nordeste do Pará, é uma cidade da Amazônia marcada por desastres ambientais. Há semanas, depois de fortes chuvas, houve um vazamento de rejeitos em uma das empresas do polo industrial, o que contaminou rios da região. No município de Barcarena já houve outros registros de crimes ambientais de contaminação.
Em 2004, a Universidade Federal do Pará (UFPA) realizou uma pesquisa que concluiu que a água consumida pela população, em 26 localidades, estava contaminada por íons de metais pesados tais como Pb2+, Cd2+ e Hg2+, descartados pelas indústrias. Amostras de água de Vila Nova, Burajuba e do Distrito Industrial apresentaram concentração de chumbo 12 vezes maior que o máximo permitido por uma resolução de 2011 do Ministério da Saúde.
https://tinyurl.com/ydhahee2 Acesso em: 06.03.2018. Adaptado.
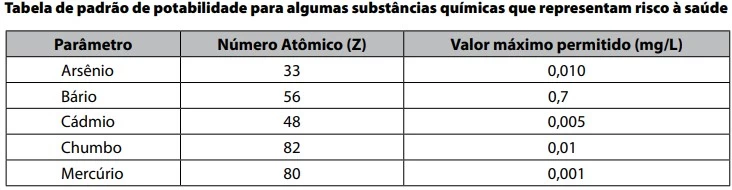
Os íons cádmio, 112 48Cd2+, presentes na água - FATEC 2018/2
Química - 2018Barcarena, no nordeste do Pará, é uma cidade da Amazônia marcada por desastres ambientais. Há semanas, depois de fortes chuvas, houve um vazamento de rejeitos em uma das empresas do polo industrial, o que contaminou rios da região. No município de Barcarena já houve outros registros de crimes ambientais de contaminação.
Em 2004, a Universidade Federal do Pará (UFPA) realizou uma pesquisa que concluiu que a água consumida pela população, em 26 localidades, estava contaminada por íons de metais pesados tais como Pb2+, Cd2+ e Hg2+, descartados pelas indústrias. Amostras de água de Vila Nova, Burajuba e do Distrito Industrial apresentaram concentração de chumbo 12 vezes maior que o máximo permitido por uma resolução de 2011 do Ministério da Saúde.
https://tinyurl.com/ydhahee2 Acesso em: 06.03.2018. Adaptado.

No atendimento a um morador de Vila Nova, o médico - FATEC 2018/2
Química - 2018Barcarena, no nordeste do Pará, é uma cidade da Amazônia marcada por desastres ambientais. Há semanas, depois de fortes chuvas, houve um vazamento de rejeitos em uma das empresas do polo industrial, o que contaminou rios da região. No município de Barcarena já houve outros registros de crimes ambientais de contaminação.
Em 2004, a Universidade Federal do Pará (UFPA) realizou uma pesquisa que concluiu que a água consumida pela população, em 26 localidades, estava contaminada por íons de metais pesados tais como Pb2+, Cd2+ e Hg2+, descartados pelas indústrias. Amostras de água de Vila Nova, Burajuba e do Distrito Industrial apresentaram concentração de chumbo 12 vezes maior que o máximo permitido por uma resolução de 2011 do Ministério da Saúde.
https://tinyurl.com/ydhahee2 Acesso em: 06.03.2018. Adaptado.

Uma das substâncias utilizadas em desinfetantes - FUVEST 2018
Química - 2018Uma das substâncias utilizadas em desinfetantes comerciais é o perácido de fórmula CH3CO3H. A formulação de um dado desinfetante encontrado no comércio consiste em uma solução aquosa na qual existem espécies químicas em equilíbrio, como representado a seguir.
(Nessa representação, a fórmula do composto 1 não é apresentada.)
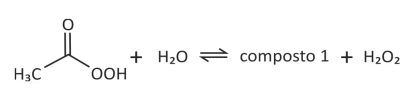
Ao abrir um frasco desse desinfetante comercial, é possível sentir o odor característico de um produto de uso doméstico.
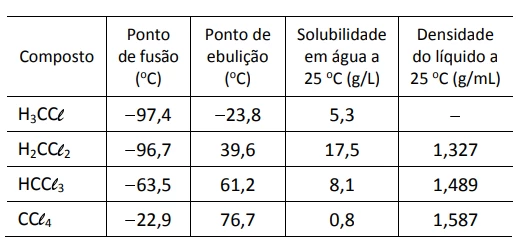
Uma determinada quantidade de metano (CH4) é colocada - FUVEST 2018
Química - 2018Uma determinada quantidade de metano (CH4) é colocada para reagir com cloro (Cl2) em excesso, a 400°C, gerando HCl (g) e os compostos organoclorados H3CCl, H2CCl2, HCCl3, CCl4, cujas propriedades são mostradas na tabela. A mistura obtida ao final das reações químicas é então resfriada a 25°C, e o líquido, formado por uma única fase e sem HCl, é coletado.
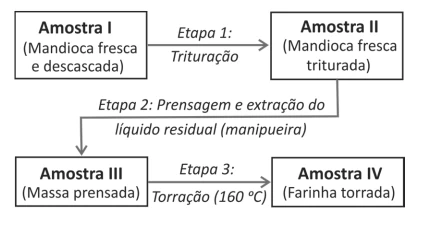
A mandioca, uma das principais fontes de carboidratos da - FUVEST 2018
Química - 2018A mandioca, uma das principais fontes de carboidratos da alimentação brasileira, possui algumas variedades conhecidas popularmente como “mandioca brava”, devido a sua toxicidade. Essa toxicidade se deve à grande quantidade de cianeto de hidrogênio (HCN) liberado quando o tecido vegetal é rompido. Após cada etapa do processamento para a produção de farinha de mandioca seca, representado pelo esquema a seguir, quantificou-se o total de HCN nas amostras, conforme mostrado no gráfico que acompanha o esquema.
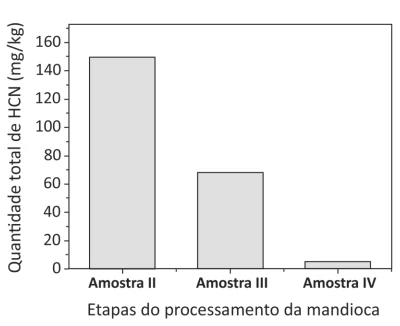
Um dos parâmetros que determina a qualidade do azeite de - FUVEST 2018
Química - 2018Um dos parâmetros que determina a qualidade do azeite de oliva é sua acidez, normalmente expressa na embalagem na forma de porcentagem, e que pode ser associada diretamente ao teor de ácido oleico em sua composição. Uma amostra de 20,00 g de um azeite comercial foi adicionada a 100 mL de uma solução contendo etanol e etoxietano (dietiléter), 1:1 em volume, com o indicador fenolftaleína. Sob constante agitação, titulouse com uma solução etanólica contendo KOH 0,020 mol/L até a ________________ total. Para essa amostra, usaram-se 35,0 mL de base, o que permite concluir que se trata de um azeite tipo ________________.
As palavras que completam corretamente as lacunas são:
Analise a tabela periódica e as seguintes afirmações a - FUVEST 2018
Química - 2018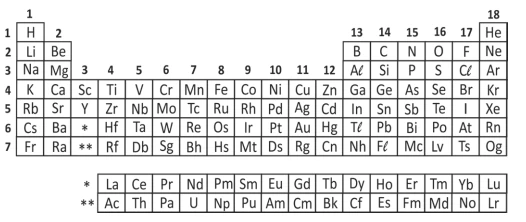
Analise a tabela periódica e as seguintes afirmações a respeito do elemento químico enxofre (S):
I. Tem massa atômica maior do que a do selênio (Se).
II. Pode formar com o hidrogênio um composto molecular de fórmula H2S.
III. A energia necessária para remover um elétron da camada mais externa do enxofre é maior do que para o sódio (Na).
IV. Pode formar com o sódio (Na) um composto iônico de fórmula Na3S.
A energia liberada na combustão do etanol de cana-de - FUVEST 2018
Química - 2018A energia liberada na combustão do etanol de cana-de-açúcar pode ser considerada advinda da energia solar, uma vez que a primeira etapa para a produção do etanol é a fotossíntese. As transformações envolvidas na produção e no uso do etanol combustível são representadas pelas seguintes equações químicas:
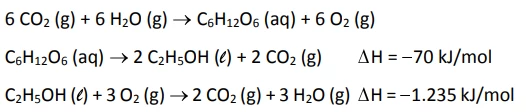
Um método largamente aplicado para evitar a corrosão em - FUVEST 2018
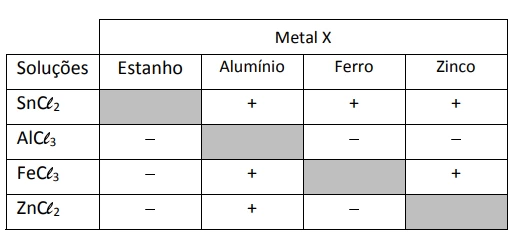
Química - 2018Um método largamente aplicado para evitar a corrosão em estruturas de aço enterradas no solo, como tanques e dutos, é a proteção catódica com um metal de sacrifício. Esse método consiste em conectar a estrutura a ser protegida, por meio de um fio condutor, a uma barra de um metal diferente e mais facilmente oxidável, que, com o passar do tempo, vai sendo corroído até que seja necessária sua substituição.

Um experimento para identificar quais metais podem ser utilizados como metal de sacrifício consiste na adição de um pedaço de metal a diferentes soluções contendo sais de outros metais, conforme ilustrado, e cujos resultados são mostrados na tabela. O símbolo ( + ) indica que foi observada uma reação química e o (–) indica que não se observou qualquer reação química.
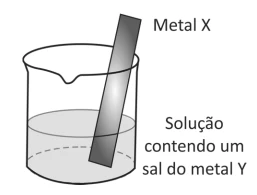
Em um laboratório químico, foi encontrado um frasco de - FUVEST 2018
Química - 2018Em um laboratório químico, foi encontrado um frasco de vidro contendo um líquido incolor e que apresentava o seguinte rótulo:
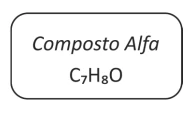
Para identificar a substância contida no frasco, foram feitos os seguintes testes: I. Dissolveram-se alguns mililitros do líquido do frasco em água, resultando uma solução neutra. A essa solução, adicionaram-se uma gota de ácido e uma pequena quantidade de um forte oxidante. Verificou-se a formação de um composto branco insolúvel em água fria, mas solúvel em água quente. A solução desse composto em água quente apresentou pH = 4. II. O sólido branco, obtido no teste anterior, foi dissolvido em etanol e a solução foi aquecida na presença de um catalisador. Essa reação produziu benzoato de etila, que é um éster aromático, de fórmula C9H10O2.
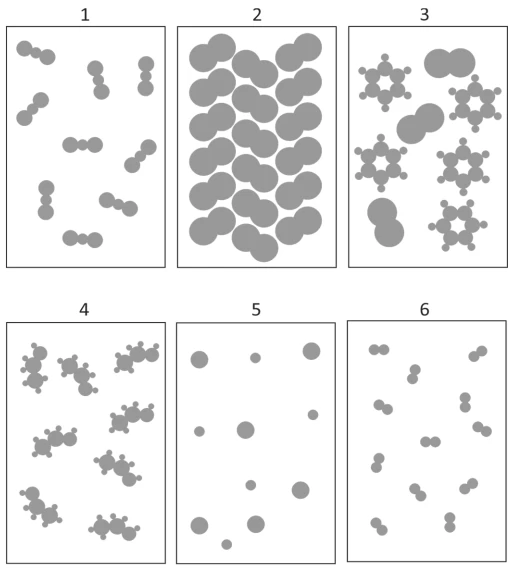
Considere as figuras pelas quais são representados - FUVEST 2018
Química - 2018Considere as figuras pelas quais são representados diferentes sistemas contendo determinadas substâncias químicas. Nas figuras, cada círculo representa um átomo, e círculos de tamanhos diferentes representam elementos químicos diferentes.
Considere um aquário tampado contendo apenas água e - FUVEST 2018
Química - 2018Considere um aquário tampado contendo apenas água e plantas aquáticas, em grande quantidade, e iluminado somente por luz solar. O gráfico que melhor esboça a variação de pH da água em função do horário do dia, considerando que os gases envolvidos na fotossíntese e na respiração das plantas ficam parcialmente dissolvidos na água, é:
O hormônio melatonina é responsável pela sensação de - FUVEST 2018
Química - 2018O hormônio melatonina é responsável pela sensação de sonolência. Em nosso organismo, a concentração de melatonina começa a aumentar ao anoitecer, atinge o máximo no meio da noite e decresce com a luz do dia. A melatonina é sintetizada a partir do aminoácido triptofano, em quatro etapas catalisadas por diferentes enzimas, sendo que a enzima 3 é degradada em presença de luz.
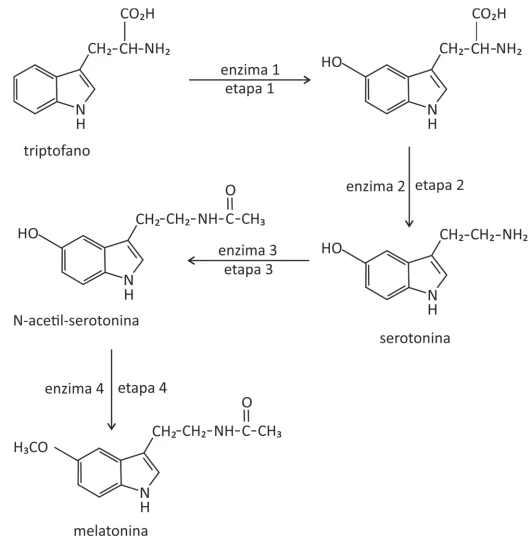
Considere as seguintes afirmações a respeito desse processo:
I. Na etapa 2, há perda de dióxido de carbono e, na etapa 3, a serotonina é transformada em uma amida.
II. A manipulação de objetos que emitem luz, como celulares e tablets, pode interromper ou tornar muito lento o processo de transformação da serotonina em N-acetil-serotonina.
III. O aumento da concentração de triptofano na corrente sanguínea pode fazer com que a pessoa adormeça mais lentamente ao anoitecer.
Neste texto, o autor descreve o fascínio que as - FUVEST 2018
Química - 2018Neste texto, o autor descreve o fascínio que as descobertas em Química exerciam sobre ele, durante sua infância.
Eu adorava Química em parte por ela ser uma ciência de transformações, de inúmeros compostos baseados em algumas dúzias de elementos, eles próprios fixos, invariáveis e eternos. A noção de estabilidade e de invariabilidade dos elementos era psicologicamente crucial para mim, pois eu os via como pontos fixos, como âncoras em um mundo instável. Mas agora, com a radioatividade, chegavam transformações das mais incríveis.
(...)
A radioatividade não alterava as realidades da Química ou a noção de elementos; não abalava a ideia de sua estabilidade e identidade. O que ela fazia era aludir a duas esferas no átomo – uma esfera relativamente superficial e acessível, que governava a reatividade e a combinação química, e uma esfera mais profunda, inacessível a todos os agentes químicos e físicos usuais e suas energias relativamente pequenas, onde qualquer mudança produzia uma alteração fundamental de identidade.
Apoie nosso trabalho!
Assine Agora