Química
Exibindo questões de 301 a 400.
Dois processos de separação de misturas descritos no - FATEC 2018
Química - 2018Estima-se que cerca de um bilhão de pessoas sofram com a falta de água potável no mundo. Para tentar combater esse tipo de problema, uma empresa desenvolveu um purificador de água distribuído na forma de um sachê que é capaz de transformar dez litros de água contaminada em dez litros de água potável. Os principais componentes do sachê são sulfato de ferro (III) e hipoclorito de cálcio.
Para purificar a água, o conteúdo do sachê deve ser despejado em um recipiente com dez litros de água não potável. Depois é preciso mexer a mistura por cinco minutos, para ocorrer a união dos íons cálcio (Ca2+) e dos íons sulfato (SO4 2–), produzindo sulfato de cálcio, que vai ao fundo do recipiente juntamente com a sujeira. Em seguida, a água deve ser passada por um filtro, que pode ser até mesmo uma camiseta de algodão limpa. Para finalizar, deve-se esperar por 20 minutos para que ocorra a ação bactericida dos íons hipoclorito, ClO1–. Assim, em pouco tempo, uma água barrenta ou contaminada se transforma em água limpa para o consumo.
Assinale a alternativa que contém a fórmula correta do - FATEC 2018
Química - 2018Estima-se que cerca de um bilhão de pessoas sofram com a falta de água potável no mundo. Para tentar combater esse tipo de problema, uma empresa desenvolveu um purificador de água distribuído na forma de um sachê que é capaz de transformar dez litros de água contaminada em dez litros de água potável. Os principais componentes do sachê são sulfato de ferro (III) e hipoclorito de cálcio.
Para purificar a água, o conteúdo do sachê deve ser despejado em um recipiente com dez litros de água não potável. Depois é preciso mexer a mistura por cinco minutos, para ocorrer a união dos íons cálcio (Ca2+) e dos íons sulfato (SO4 2–), produzindo sulfato de cálcio, que vai ao fundo do recipiente juntamente com a sujeira. Em seguida, a água deve ser passada por um filtro, que pode ser até mesmo uma camiseta de algodão limpa. Para finalizar, deve-se esperar por 20 minutos para que ocorra a ação bactericida dos íons hipoclorito, ClO1–. Assim, em pouco tempo, uma água barrenta ou contaminada se transforma em água limpa para o consumo.
Os números de oxidação do enxofre e do cloro nos íons SO4 - FATEC 2018
Química - 2018Estima-se que cerca de um bilhão de pessoas sofram com a falta de água potável no mundo. Para tentar combater esse tipo de problema, uma empresa desenvolveu um purificador de água distribuído na forma de um sachê que é capaz de transformar dez litros de água contaminada em dez litros de água potável. Os principais componentes do sachê são sulfato de ferro (III) e hipoclorito de cálcio.
Para purificar a água, o conteúdo do sachê deve ser despejado em um recipiente com dez litros de água não potável. Depois é preciso mexer a mistura por cinco minutos, para ocorrer a união dos íons cálcio (Ca2+) e dos íons sulfato (SO4 2–), produzindo sulfato de cálcio, que vai ao fundo do recipiente juntamente com a sujeira. Em seguida, a água deve ser passada por um filtro, que pode ser até mesmo uma camiseta de algodão limpa. Para finalizar, deve-se esperar por 20 minutos para que ocorra a ação bactericida dos íons hipoclorito, ClO1–. Assim, em pouco tempo, uma água barrenta ou contaminada se transforma em água limpa para o consumo.
É correto afirmar que os compostos orgânicos responsáveis - FATEC 2018
Química - 2018De onde vem o cheiro de carro novo?
De acordo com o gerente de uma montadora de veículos, o cheiro é composto por uma combinação de vários tipos de substâncias químicas usadas na fabricação do veículo, incluindo solventes, plásticos, colas, tecidos e borracha. Porém, muitas delas são altamente tóxicas, porque contêm Compostos Orgânicos Voláteis (COVs) em sua composição, como benzeno, tolueno e formol, que podem ser letais dependendo da quantidade. Eles acabam escapando e impregnando o ar, porque não requerem altas temperaturas para evaporarem.
O benzeno sofre reação de combustão segundo a equação - FATEC 2018
Química - 2018De onde vem o cheiro de carro novo?
De acordo com o gerente de uma montadora de veículos, o cheiro é composto por uma combinação de vários tipos de substâncias químicas usadas na fabricação do veículo, incluindo solventes, plásticos, colas, tecidos e borracha. Porém, muitas delas são altamente tóxicas, porque contêm Compostos Orgânicos Voláteis (COVs) em sua composição, como benzeno, tolueno e formol, que podem ser letais dependendo da quantidade. Eles acabam escapando e impregnando o ar, porque não requerem altas temperaturas para evaporarem.
http://tinyurl.com/y8ucob6c Acesso em: 13.11.2017. Adaptado.
O benzeno sofre reação de combustão segundo a equação balanceada
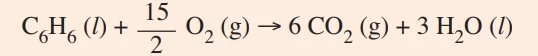
A entalpia de combustão do benzeno pode ser determinada conhecendo-se os valores das entalpias de formação do gás carbônico, assim como da água e do benzeno líquidos.
A tabela apresenta os valores de entalpia de formação de algumas substâncias nas condições padrão.
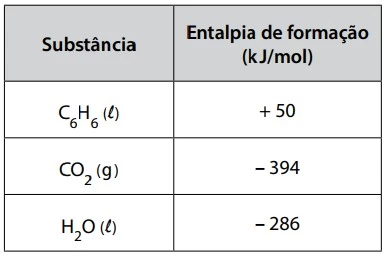
No interior de uma célula mantida a 40 ºC ocorreu uma - UNESP 2018/2
Química - 2018No interior de uma célula mantida a 40 ºC ocorreu uma reação bioquímica enzimática exotérmica. O gráfico 1 mostra a energia de ativação (Ea) envolvida no processo e o gráfico 2 mostra a atividade da enzima que participa dessa reação, em relação à variação da temperatura.
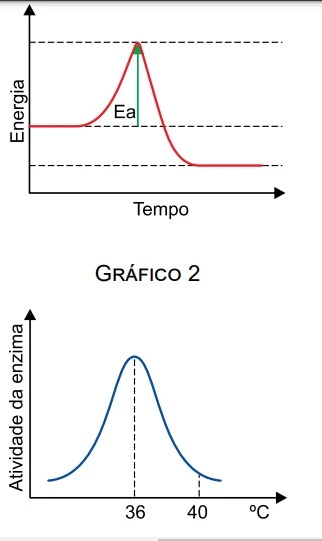
A galvanoplastia consiste em revestir um metal por - UNICAMP 2018
Química - 2018A galvanoplastia consiste em revestir um metal por outro a fim de protegê-lo contra a corrosão ou melhorar sua aparência. O estanho, por exemplo, é utilizado como revestimento do aço empregado em embalagens de alimentos. Na galvanoplastia, a espessura da camada pode ser controlada com a corrente elétrica e o tempo empregados. A figura abaixo é uma representação esquemática desse processo.
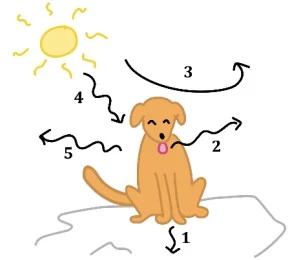
Mesmo em manhãs bem quentes, é comum ver um cão tomando - UNICAMP 2018
Química - 2018Mesmo em manhãs bem quentes, é comum ver um cão tomando sol. O pelo do animal esquenta e sua língua do lado de fora sugere que ele está cansado. O pelo do animal está muito quente, mas mesmo assim o cão permanece ao sol, garantindo a produção de vitamina D3. Durante essa exposição ao sol, ocorrem transferências de energia entre o cão e o ambiente, por processos indicados por números na figura abaixo.
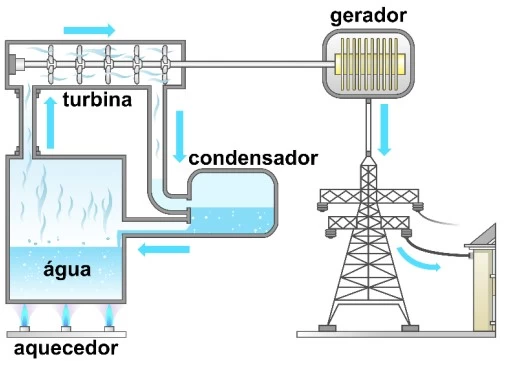
Com a crise hídrica de 2015 no Brasil, foi necessário - UNICAMP 2018
Química - 2018Com a crise hídrica de 2015 no Brasil, foi necessário ligar as usinas termoelétricas para a geração de eletricidade, medida que fez elevar o custo da energia para os brasileiros. O governo passou então a adotar bandeiras de cores diferentes na conta de luz para alertar a população. A bandeira vermelha indicaria que a energia estaria mais cara. O esquema a seguir representa um determinado tipo de usina termoelétrica.
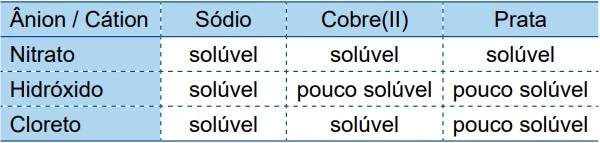
O quadro fornece indicações sobre a solubilidade de - UNESP 2018/2
Química - 2018O quadro fornece indicações sobre a solubilidade de alguns compostos iônicos inorgânicos em água a 20ºC.
Icebergs flutuam na água do mar, assim como o gelo em - UNICAMP 2018
Química - 2018Icebergs flutuam na água do mar, assim como o gelo em um copo com água potável. Imagine a situação inicial de um copo com água e gelo, em equilíbrio térmico à temperatura de 0 °C.
O cloreto de cobalto(II) anidro, CoCl 2, é um sal de - UNESP 2018/2
Química - 2018O cloreto de cobalto(II) anidro, CoCl2, é um sal de cor azul, que pode ser utilizado como indicador de umidade, pois torna-se rosa em presença de água. Obtém-se esse sal pelo aquecimento do cloreto de cobalto(II) hexahidratado, CoCl2 . 6H2O, de cor rosa, com liberação de vapor de água.

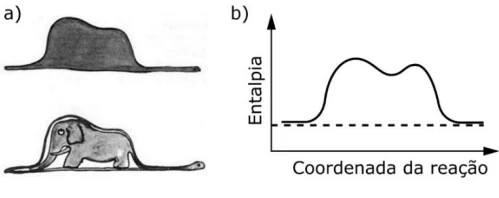
O livro O Pequeno Príncipe, de Antoine de Saint-Exupéry - UNICAMP 2018
Química - 2018O livro O Pequeno Príncipe, de Antoine de Saint-Exupéry, uma das obras literárias mais traduzidas no mundo, traz ilustrações inspiradas na experiência do autor como aviador no norte da África. Uma delas, a figura (a), parece representar um chapéu ou um elefante engolido por uma jiboia, dependendo de quem a interpreta.
Dos extensos efeitos nocivos que a radiação ionizante - UNESP 2018/2
Química - 2018Dos extensos efeitos nocivos que a radiação ionizante provoca na matéria viva, afigura-se a geração de radicais livres, que são espécies químicas eletricamente neutras que apresentam um ou mais elétrons desemparelhados na camada de valência. O íon cloreto, por exemplo, que, quantitativamente, constitui o principal ânion do plasma, transforma-se no radical livre Cl•, com 7 elétrons na camada de valência, podendo, assim, reagir facilmente com as biomoléculas, alterando o comportamento bioquímico de muitas proteínas solúveis do meio sanguíneo e também os constituintes membranários de células: hemácias, leucócitos, plaquetas.
Em 12 de maio de 2017 o Metrô de São Paulo trocou 240 - UNICAMP 2018
Química - 2018Em 12 de maio de 2017 o Metrô de São Paulo trocou 240 metros de trilhos de uma de suas linhas, numa operação feita de madrugada, em apenas três horas. Na solda entre o trilho novo e o usado empregou-se uma reação química denominada térmita, que permite a obtenção de uma temperatura local de cerca de 2.000°C. A reação utilizada foi entre um óxido de ferro e o alumínio metálico.
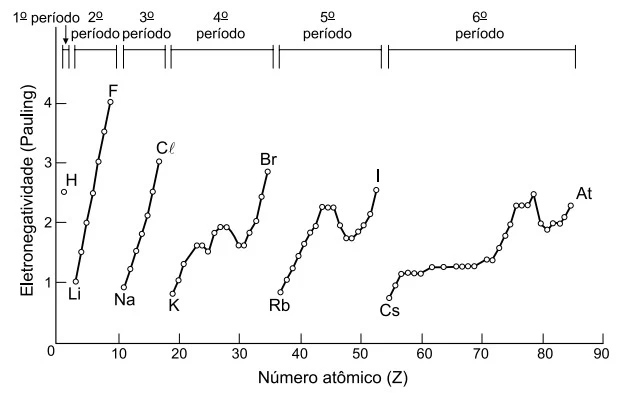
Analise o gráfico que mostra a variação da - UNESP 2018/2
Química - 2018Analise o gráfico que mostra a variação da eletronegatividade em função do número atômico.
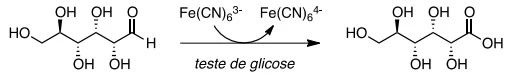
No Brasil, cerca de 12 milhões de pessoas sofrem de dia - UNICAMP 2018
Química - 2018No Brasil, cerca de 12 milhões de pessoas sofrem de diabetes mellitus, uma doença causada pela incapacidade do corpo em produzir insulina ou em utilizá-la adequadamente. No teste eletrônico para determinar a concentração da glicose sanguínea, a glicose é transformada em ácido glucônico e o hexacianoferrato(III) é transformado em hexacianoferrato(II), conforme mostra o esquema a seguir.
A concentração de cloreto de sódio no soro fisiológico - UNESP 2018/2
Química - 2018A concentração de cloreto de sódio no soro fisiológico é 0,15 mol/L.
Mais de 2.000 plantas produzem látex, a partir do qual - UNICAMP 2018
Química - 2018Mais de 2.000 plantas produzem látex, a partir do qual se produz a borracha natural. A Hevea brasiliensis (seringueira) é a mais importante fonte comercial desse látex. O látex da Hevea brasiliensis consiste em um polímero do cis-1,4-isopreno, fórmula C5H8, com uma massa molecular média de 1.310 kDa (quilodaltons). De acordo com essas informações, a seringueira produz um polímero que tem em média
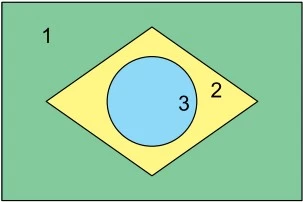
Para sua apresentação em um “show de química”, um grupo - UNESP 2018/2
Química - 2018Para sua apresentação em um “show de química”, um grupo de estudantes confeccionou um recipiente com três compartimentos, 1, 2 e 3, dispostos de modo a lembrar o formato da bandeira brasileira. A esses compartimentos, adicionaram três soluções aquosas diferentes, todas incolores e de concentração igual a 0,1 mol/L, uma em cada compartimento. O recipiente foi mantido em posição horizontal.
Em seguida, acrescentaram em cada compartimento o indicador azul de bromotimol, que apresenta cor azul em pH > 7,6 e amarela em pH < 6,0. Como resultado, o recipiente apresentou as cores da bandeira nacional, conforme mostra a figura.
Na preparação da calda bordalesa são usados 100 g de - UNICAMP 2018
Química - 2018A calda bordalesa é uma das formulações mais antigas e mais eficazes que se conhece. Ela foi descoberta na França no final do século XIX, quase por acaso, por um agricultor que aplicava água de cal nos cachos de uva para evitar que fossem roubados; a cal promovia uma mudança na aparência e no sabor das uvas. O agricultor logo percebeu que as plantas assim tratadas estavam livres de antracnose.
Estudando-se o caso, descobriu-se que o efeito estava associado ao fato de a água de cal ter sido preparada em tachos de cobre. Atualmente, para preparar a calda bordalesa, coloca-se o sulfato de cobre em um pano de algodão que é mergulhado em um vasilhame plástico com água morna.
Paralelamente, coloca-se cal em um balde e adiciona-se água aos poucos. Após quatro horas, adiciona-se aos poucos, e mexendo sempre, a solução de sulfato de cobre à água de cal.
No que diz respeito aos ciclos de combustíveis - UNESP 2018/2
Química - 2018No que diz respeito aos ciclos de combustíveis nucleares empregados nos reatores, a expressão “fértil” refere-se ao material que produz um nuclídeo físsil após captura de nêutron, sendo que a expressão “físsil” refere-se ao material cuja captura de nêutron é seguida de fissão nuclear.
(José Ribeiro da Costa. Curso de introdução ao estudo dos ciclos de combustível, 1972. Adaptado.)
Assim, o nuclídeo Th-232 é considerado fértil, pois produz nuclídeo físsil, pela sequência de reações nucleares:

Na formulação da calda bordalesa fornecida pela EMATER - UNICAMP 2018
Química - 2018A calda bordalesa é uma das formulações mais antigas e mais eficazes que se conhece. Ela foi descoberta na França no final do século XIX, quase por acaso, por um agricultor que aplicava água de cal nos cachos de uva para evitar que fossem roubados; a cal promovia uma mudança na aparência e no sabor das uvas. O agricultor logo percebeu que as plantas assim tratadas estavam livres de antracnose.
Estudando-se o caso, descobriu-se que o efeito estava associado ao fato de a água de cal ter sido preparada em tachos de cobre. Atualmente, para preparar a calda bordalesa, coloca-se o sulfato de cobre em um pano de algodão que é mergulhado em um vasilhame plástico com água morna.
Paralelamente, coloca-se cal em um balde e adiciona-se água aos poucos. Após quatro horas, adiciona-se aos poucos, e mexendo sempre, a solução de sulfato de cobre à água de cal.
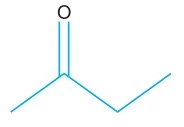
A fórmula representa a estrutura da butanona, também - UNESP 2018/2
Química - 2018A fórmula representa a estrutura da butanona, também conhecida como metiletilcetona (MEK), importante solvente industrial usado em tintas e resinas.
A formação da ferrugem (corrosão do ferro) é uma reação de oxirredução
Química - 2018A formação da ferrugem (corrosão do ferro) é uma reação de oxirredução entre o ferro metálico e o oxigênio do ar. Uma forma de evitar a corrosão é proteger o ferro por meio da galvanização, isto é, recobrir a superfície da peça metálica com uma película de zinco. A camada de zinco impede a oxidação do ferro porque evita que ele entre em contato com a umidade do ar. Se a peça galvanizada for riscada, o ferro tende a oxidar nesse local, mas, imediatamente, ocorre a oxidação do zinco e o ferro é reduzido novamente aferro metálico, fazendo assim a proteção
O dióxido de carbono, causador do efeito estufa, é um dos poluentes
Química - 2018DADOS QUE PODEM SER USADOS NESTA QUESTÃO
Observando o Princípio de Avogadro (1776 - 1856), estabelecido em 1811
Química - 2018DADOS QUE PODEM SER USADOS NESTA QUESTÃO

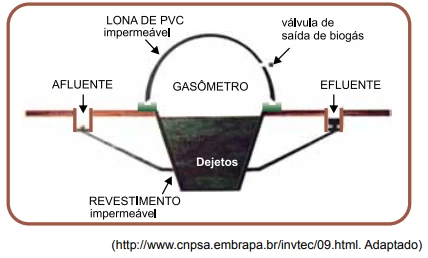
Na figura, apresenta-se um biodigestor utilizado em áreas - FGV 2016
Química - 2018Na figura, apresenta-se um biodigestor utilizado em áreas rurais. Ele é totalmente vedado, criando um ambiente anaeróbio onde os microrganismos degradam o material orgânico (dejetos e restos de ração), transformando-o em biogás. O gasômetro é o compartimento superior do biodigestor e serve para a armazenagem de gases. Ele é inflável e feito de uma manta de material plástico impermeável (PVC). No gasômetro, a pressão e a temperatura são constantemente iguais às da atmosfera.
O íon Ca2+ e o átomo Ar apresentam o mesmo 20 18 número - FAMERP 2018
Química - 2018O íon  e o átomo
e o átomo 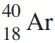 apresentam o mesmo número
apresentam o mesmo número
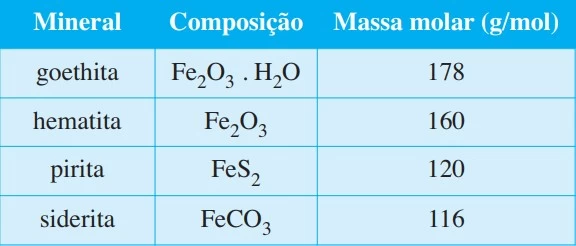
Analise a tabela, que mostra a composição de alguns - FAMERP 2018
Química - 2018Analise a tabela, que mostra a composição de alguns minerais de ferro.
Um isqueiro descartável contém gás isobutano (C4H10). - FAMERP 2018
Química - 2018Um isqueiro descartável contém gás isobutano (C4H10).
Sulfato de amônio e nitrato de potássio são compostos - FAMERP 2018
Química - 2018Sulfato de amônio e nitrato de potássio são compostos __________________, classificados como ___________, amplamente empregados na composição de _________.
Soluções aquosas de amônia e de soda cáustica, de iguais - FAMERP 2018
Química - 2018Soluções aquosas de amônia e de soda cáustica, de iguais concentrações em mol/L,
Em uma suspensão aquosa de cal hidratada ocorre o - FAMERP 2018
Química - 2018Em uma suspensão aquosa de cal hidratada ocorre o seguinte equilíbrio:
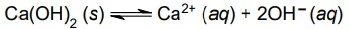
Um modo de testar a presença de vitamina C (ácido - FAMERP 2018
Química - 2018Um modo de testar a presença de vitamina C (ácido ascórbico) em um suco de frutas é acrescentar solução de iodo (I2). A vitamina C reage com iodo formando ácido dehidroascórbico e ácido iodídrico (HI).
Uma amostra de certo radioisótopo do elemento iodo teve - FAMERP 2018
Química - 2018Uma amostra de certo radioisótopo do elemento iodo teve sua atividade radioativa reduzida a 12,5% da atividade inicial após um período de 24 dias.
O número de isômeros de cadeia aberta e saturada - FAMERP 2018
Química - 2018O número de isômeros de cadeia aberta e saturada coerentes com a fórmula molecular C5H12 é
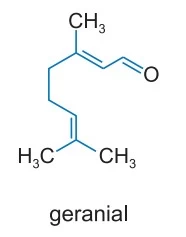
A fórmula representa a estrutura do geranial, também - FAMERP 2018
Química - 2018A fórmula representa a estrutura do geranial, também conhecido como citral A, um dos compostos responsáveis pelo aroma do limão.
Considere os elementos K, Co, As e Br, todos localizados - UNESP 2018
Química - 2018Considere os elementos K, Co, As e Br, todos localizados no quarto período da Classificação Periódica.
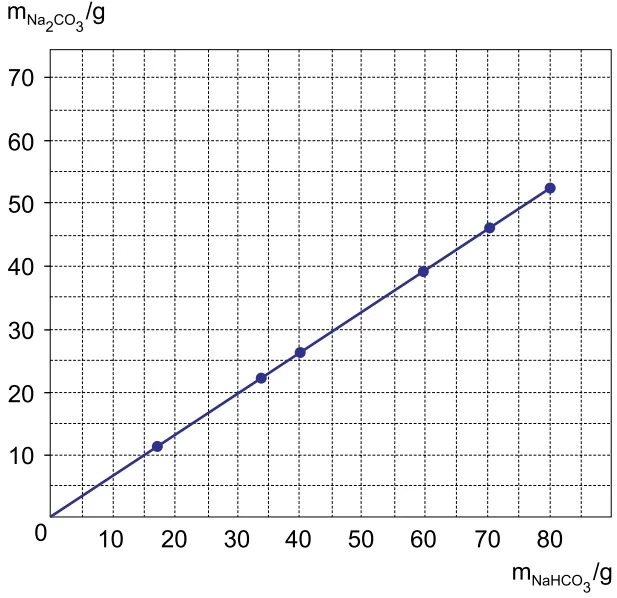
Bicarbonato de sódio sólido aquecido se decompõe - UNESP 2018
Química - 2018Bicarbonato de sódio sólido aquecido se decompõe, produzindo carbonato de sódio sólido, além de água e dióxido de carbono gasosos. O gráfico mostra os resultados de um experimento em que foram deter minadas as massas de carbonato de sódio obtidas pela decomposição de diferentes massas de bicarbonato de sódio.
De acordo com o Relatório Anual de 2016 da Qualidade da - UNESP 2018
Química - 2018De acordo com o Relatório Anual de 2016 da Qualidade da Água, publicado pela Sabesp, a concentração de cloro na água potável da rede de distribuição deve estar entre 0,2 mg/L, limite mínimo, e 5,0 mg/L, limite máximo.
Sob temperatura constante, acrescentou-se cloreto de - UNESP 2018
Química - 2018Sob temperatura constante, acrescentou-se cloreto de sódio em água até sobrar sal sem se dissolver, como corpo de fundo. Estabeleceu-se assim o seguinte equilíbrio:
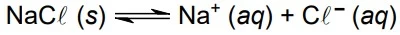
Mantendo a temperatura constante, foi acrescentada mais uma porção de NaCl (s). Com isso, observa-se que a condutibilidade elétrica da solução sobrenadante _________, a quantidade de corpo de fundo ________ e a concentração de íons em solução _________.
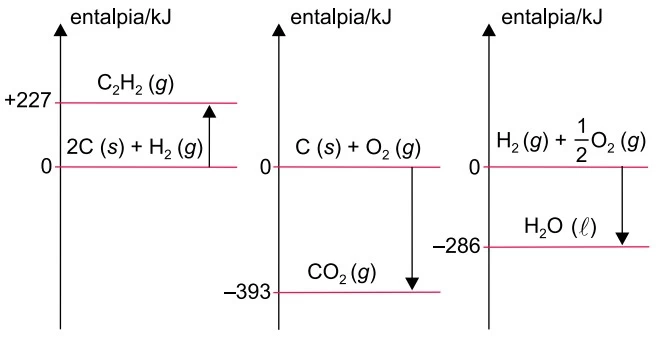
Analise os três diagramas de entalpia. O ΔH da combustão - UNESP 2018
Química - 2018Analise os três diagramas de entalpia.
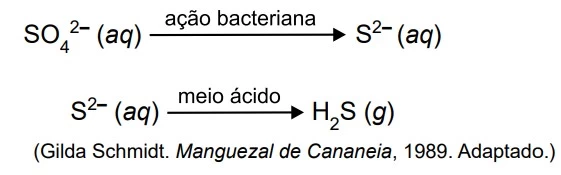
O ciclo do enxofre é fundamental para os solos dos - UNESP 2018
Química - 2018O ciclo do enxofre é fundamental para os solos dos manguezais. Na fase anaeróbica, bactérias reduzem o sulfato para produzir o gás sulfeto de hidrogênio. Os processos que ocorrem são os seguintes:
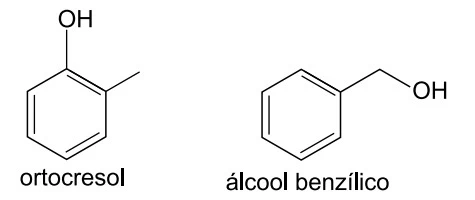
Examine as estruturas do ortocresol e do álcool benzílico - UNESP 2018
Química - 2018Examine as estruturas do ortocresol e do álcool benzílico.
Muitos problemas sociais e ambientais têm-se tornado - UNICAMP 2017
Química - 2017Muitos problemas sociais e ambientais têm-se tornado motivo de piadas e alvo de charges em jornais e revistas. Um exemplo deste tipo está mostrado nas figuras abaixo.

“Ferro Velho Coisa Nova” e “Compro Ouro Velho” são - UNICAMP 2017
Química - 2017“Ferro Velho Coisa Nova” e “Compro Ouro Velho” são expressões associadas ao comércio de dois materiais que podem ser reaproveitados.
Bebidas gaseificadas apresentam o inconveniente de - UNICAMP 2017
Química - 2017Bebidas gaseificadas apresentam o inconveniente de perderem a graça depois de abertas. A pressão do CO2 no interior de uma garrafa de refrigerante, antes de ser aberta, gira em torno de 3,5 atm, e é sabido que, depois de aberta, ele não apresenta as mesmas características iniciais.
É muito comum o uso de expressões no diminutivo para - UNICAMP 2017
Química - 2017É muito comum o uso de expressões no diminutivo para tentar “diminuir” a quantidade de algo prejudicial à saúde.
Se uma pessoa diz que ingeriu 10 latinhas de cerveja (330 mL cada) e se compara a outra que ingeriu 6 doses de cachacinha (50 mL cada), pode-se afirmar corretamente que, apesar de em ambas as situações haver danos à saúde, a pessoa que apresenta maior quantidade de álcool no organismo foi a que ingeriu
Uma alternativa encontrada nos grandes centros urbanos - UNICAMP 2017
Química - 2017Uma alternativa encontrada nos grandes centros urbanos, para se evitar que pessoas desorientadas urinem nos muros de casas e estabelecimentos comerciais, é revestir esses muros com um tipo de tinta que repele a urina e, assim, “devolve a urina” aos seus verdadeiros donos. A figura a seguir apresenta duas representações para esse tipo de revestimento.
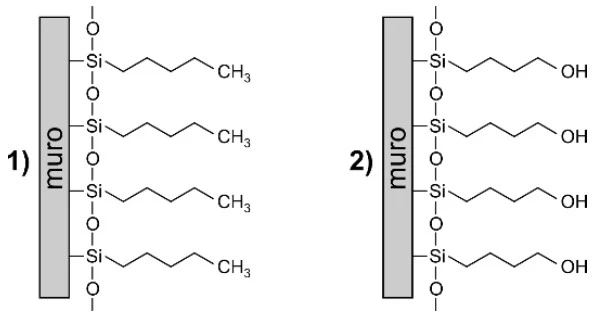
“Quem tem que suar é o chope, não você”. Esse é o - UNICAMP 2017
Química - 2017“Quem tem que suar é o chope, não você”. Esse é o slogan que um fabricante de chope encontrou para evidenciar as qualidades de seu produto. Uma das interpretações desse slogan é que o fabricante do chope recomenda que seu produto deve ser ingerido a uma temperatura bem baixa.
“Pode arredondar?” Esta é uma pergunta que frentistas - UNICAMP 2017
Química - 2017“Pode arredondar?” Esta é uma pergunta que frentistas de postos de combustíveis fazem durante o abastecimento, quando o travamento automático da bomba é acionado. O fabricante do veículo faz a recomendação de não arredondar, pensando na preservação do veículo, mas o dono do posto pede que o frentista arredonde, para vender mais combustível.
Um filme de ficção muito recente destaca o isótopo - UNICAMP 2017
Química - 2017Um filme de ficção muito recente destaca o isótopo 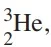 , muito abundante na Lua, como uma solução para a produção de energia limpa na Terra. Uma das transformações que esse elemento pode sofrer, e que justificaria seu uso como combustível, está esquematicamente representada na reação abaixo, em que o
, muito abundante na Lua, como uma solução para a produção de energia limpa na Terra. Uma das transformações que esse elemento pode sofrer, e que justificaria seu uso como combustível, está esquematicamente representada na reação abaixo, em que o 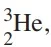 aparece como reagente.
aparece como reagente.
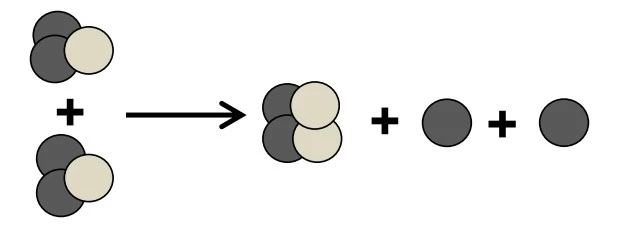
O etilenoglicol é uma substância muito solúvel em água - UNICAMP 2017
Química - 2017O etilenoglicol é uma substância muito solúvel em água, largamente utilizado como aditivo em radiadores de motores de automóveis, tanto em países frios como em países quentes.
Durante o ciclo hidrológico ocorrem diversas mudanças - FAMERP 2017
Química - 2017Durante o ciclo hidrológico ocorrem diversas mudanças de estado físico da água. Um exemplo de mudança de estado denominada sublimação ocorre quando
Nos minerais estroncianita e celestita, o elemento - FAMERP 2017
Química - 2017Leia o texto para responder às questões 52 e 53.
O elemento estrôncio ocorre na natureza como componente de dois minerais: a estroncianita, SrCO3 (massa molar 147,6 g/mol), e a celestita, SrSO4 (massa molar 183,6 g/mol). A partir desses minerais são obtidos os sais de estrôncio, utilizados na pirotecnia para conferir a cor vermelho-carmim intensa a fogos de artifício.
Considere a relação: % em massa de Sr na estroncianita - FAMERP 2017
Química - 2017Leia o texto para responder às questões 52 e 53.
O elemento estrôncio ocorre na natureza como componente de dois minerais: a estroncianita, SrCO3 (massa molar 147,6 g/mol), e a celestita, SrSO4 (massa molar 183,6 g/mol). A partir desses minerais são obtidos os sais de estrôncio, utilizados na pirotecnia para conferir a cor vermelho-carmim intensa a fogos de artifício.
O bicarbonato de sódio, NaHCO3 (s), ao ser aquecido - FAMERP 2017
Química - 2017O bicarbonato de sódio, NaHCO3 (s), ao ser aquecido, sofre transformação química produzindo carbonato de sódio, Na2CO3 (s), dióxido de carbono, CO2 (g), e vapor de água, H2O (g).
A ligação química existente entre os átomos de cloro na - FAMERP 2017
Química - 2017A ligação química existente entre os átomos de cloro na molécula do gás cloro é do tipo covalente
A mistura conhecida como soro fisiológico é um exemplo - FAMERP 2017
Química - 2017A mistura conhecida como soro fisiológico é um exemplo de __________, na qual o ____________ é a água e o _____________ é o ____________ de sódio.
Considere os seguintes óxidos: CaO, CO, N2O, CO2, NO2 e - FAMERP 2017
Química - 2017Considere os seguintes óxidos: CaO, CO, N2O, CO2, NO2 e K2O.
A energia liberada na combustão do etanol hidratado é - FAMERP 2017
Química - 2017A energia liberada na combustão do etanol hidratado é cerca de 70% da energia liberada na combustão de igual volume de gasolina. Considere que o calor específico da água líquida seja 1 cal . g–1. °C–1. Em um experimento, a combustão de um volume V de etanol hidratado em um calorímetro permitiu elevar a temperatura de 200 g de água líquida de 25°C a 60 °C.
O ácido nítrico é obtido a partir da amônia por um - FAMERP 2017
Química - 2017O ácido nítrico é obtido a partir da amônia por um processo que pode ser representado pela reação global:
NH3 (g) + 2O2 (g) → HNO3 (aq) + H2O (l)
A fórmula corresponde à estrutura do antisséptico - FAMERP 2017
Química - 2017A fórmula corresponde à estrutura do antisséptico cloreto de benzetônio.
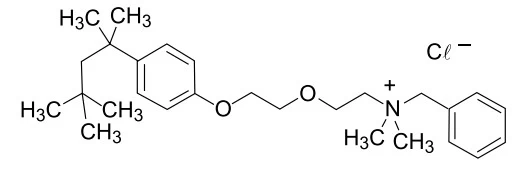
Dependendo do pH do solo, os nutrientes nele existentes - FUVEST 2017
Química - 2017Dependendo do pH do solo, os nutrientes nele existentes podem sofrer transformações químicas que dificultam sua absorção pelas plantas. O quadro mostra algumas dessas transformações, em função do pH do solo.
Em ambientes naturais e na presença de água e gás - FUVEST 2017
Química - 2017Em ambientes naturais e na presença de água e gás oxigênio, a pirita, um mineral composto principalmente por dissulfeto de ferro (FeS2), sofre processos de intemperismo, o que envolve transformações químicas que acontecem ao longo do tempo. Um desses processos pode ser descrito pelas transformações sucessivas, representadas pelas seguintes equações químicas:
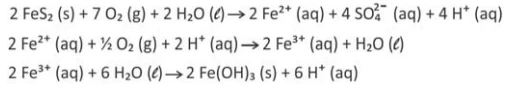
Considerando a equação química que representa a transformação global desse processo, as lacunas da frase “No intemperismo sofrido pela pirita, a razão entre as quantidades de matéria do FeS2 (s) e do O2 (g) é __________, e, durante o processo, o pH do solo __________” podem ser corretamente preenchidas por
Um estudante realizou um experimento para avaliar a - FUVEST 2017
Química - 2017Um estudante realizou um experimento para avaliar a reatividade dos metais Pb, Zn e Fe. Para isso, mergulhou, em separado, uma pequena placa de cada um desses metais em cada uma das soluções aquosas dos nitratos de chumbo, de zinco e de ferro. Com suas observações, elaborou a seguinte tabela, em que (sim) significa formação de sólido sobre a placa e (não) significa nenhuma evidência dessa formação:
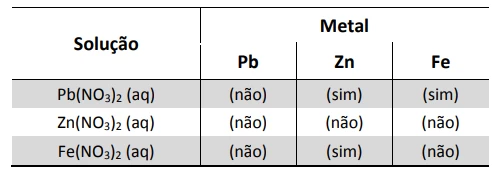
A seguir, montou três diferentes pilhas galvânicas, conforme esquematizado.
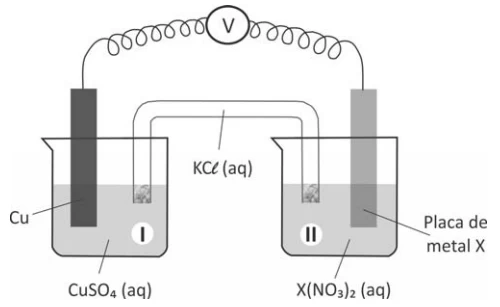
Em uma aula experimental, dois grupos de alunos (G1 e - FUVEST 2017
Química - 2017Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração. O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela). O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).
Tabela: dados obtidos pelo grupo G1.

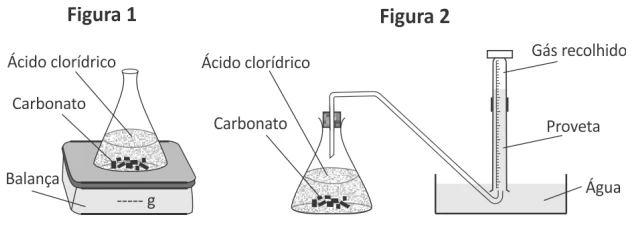
Nas mesmas condições de pressão e temperatura, 50 L de - FUVEST 2017
Química - 2017Nas mesmas condições de pressão e temperatura, 50 L de gás propano (C3H8) e 250 L de ar foram colocados em um reator, ao qual foi fornecida energia apenas suficiente para iniciar a reação de combustão. Após algum tempo, não mais se observou a liberação de calor, o que indicou que a reação havia-se encerrado.
Com base nessas observações experimentais, três afirmações foram feitas:
I. Se tivesse ocorrido apenas combustão incompleta, restaria propano no reator.
II. Para que todo o propano reagisse, considerando a combustão completa, seriam necessários, no mínimo, 750 L de ar.
III. É provável que, nessa combustão, tenha se formado fuligem.
Para aumentar o grau de conforto do motorista e - FUVEST 2017
Química - 2017Para aumentar o grau de conforto do motorista e contribuir para a segurança em dias chuvosos, alguns materiais podem ser aplicados no para-brisa do veículo, formando uma película que repele a água. Nesse tratamento, ocorre uma transformação na superfície do vidro, a qual pode ser representada pela seguinte equação química não balanceada:
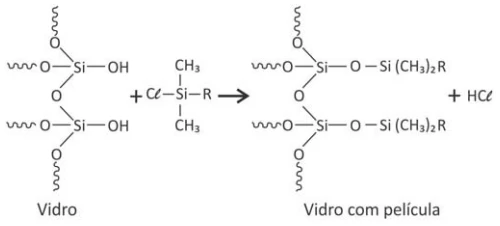
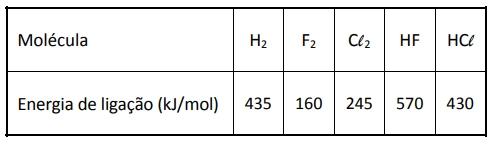
Sob certas condições, tanto o gás flúor quanto o gás - FUVEST 2017
Química - 2017Sob certas condições, tanto o gás flúor quanto o gás cloro podem reagir com hidrogênio gasoso, formando, respectivamente, os haletos de hidrogênio HF e HCl, gasosos. Pode-se estimar a variação de entalpia (ΔH) de cada uma dessas reações, utilizando-se dados de energia de ligação. A tabela apresenta os valores de energia de ligação dos reagentes e produtos dessas reações a 25°C e 1 atm.
Considere as seguintes características da moeda de - UNESP 2017/2
Química - 2017Considere as seguintes características da moeda de R$ 0,10: massa = 4,8 g; diâmetro = 20,0 mm; espessura = 2,2 mm.

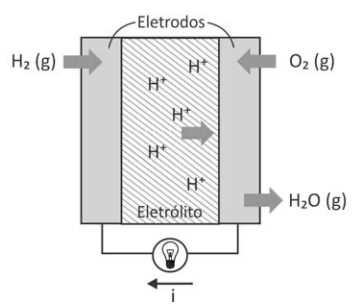
Células a combustível são opções viáveis para gerar - FUVEST 2017
Química - 2017Células a combustível são opções viáveis para gerar energia elétrica para motores e outros dispositivos. O esquema representa uma dessas células e as transformações que nela ocorrem.
H2 (g) + 1/2 O2 (g) → H2O (g)
ΔH = – 240 kJ/mol de H2
Diversos compostos do gás nobre xenônio foram - UNESP 2017/2
Química - 2017Diversos compostos do gás nobre xenônio foram sintetizados a partir dos anos 60 do século XX, fazendo cair por terra a ideia que se tinha sobre a total estabilidade dos gases nobres, que eram conhecidos como gases inertes. Entre esses compostos está o tetrafluoreto de xenônio (XeF4), um sólido volátil obtido pela reação, realizada a 400ºC, entre xenônio e flúor gasosos.
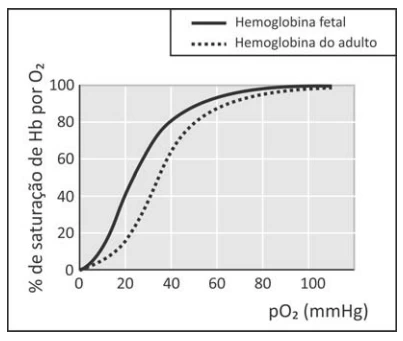
A hemoglobina (Hb) é a proteína responsável pelo - FUVEST 2017
Química - 2017A hemoglobina (Hb) é a proteína responsável pelo transporte de oxigênio. Nesse processo, a hemoglobina se transforma em oxi-hemoglobina (Hb(O2)n). Nos fetos, há um tipo de hemoglobina diferente da do adulto, chamada de hemoglobina fetal. O transporte de oxigênio pode ser representado pelo seguinte equilíbrio:
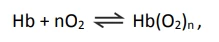
em que Hb representa tanto a hemoglobina do adulto quanto a hemoglobina fetal. A figura mostra a porcentagem de saturação de Hb por O2 em função da pressão parcial de oxigênio no sangue humano, em determinado pH e em determinada temperatura.
A porcentagem de saturação pode ser entendida como:
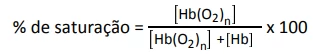
Com base nessas informações, um estudante fez as seguintes afirmações:
I. Para uma pressão parcial de O2 de 30 mmHg, a hemoglobina fetal transporta mais oxigênio do que a hemoglobina do adulto.
II. Considerando o equilíbrio de transporte de oxigênio, no caso de um adulto viajar do litoral para um local de grande altitude, a concentração de Hb em seu sangue deverá aumentar, após certo tempo, para que a concentração de Hb(O2)n seja mantida.
III. Nos adultos, a concentração de hemoglobina associada a oxigênio é menor no pulmão do que nos tecidos.
A carga elétrica do elétron é –1,6 x 10–19 C e a do - UNESP 2017/2
Química - 2017A carga elétrica do elétron é –1,6 x 10–19 C e a do próton é +1,6 × 10–19 C. A quantidade total de carga elétrica resultante presente na espécie química representada por 40Ca2+ é igual a
A dopamina é um neurotransmissor importante em processos - FUVEST 2017
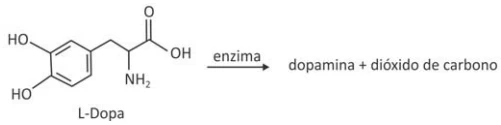
Química - 2017A dopamina é um neurotransmissor importante em processos cerebrais. Uma das etapas de sua produção no organismo humano é a descarboxilação enzimática da L-Dopa, como esquematizado:
A 20 ºC, a solubilidade do açúcar comum (C12H22O11; - UNESP 2017/2
Química - 2017A 20 ºC, a solubilidade do açúcar comum (C12H22O11; massa molar = 342 g/mol) em água é cerca de 2,0 kg/L, enquanto a do sal comum (NaCl; massa molar = 58,5 g/mol) é cerca de 0,35 kg/L. A comparação de iguais volumes de soluções saturadas dessas duas substâncias permite afirmar corretamente que, em relação à quantidade total em mol de íons na solução de sal, a quantidade total em mol de moléculas de soluto dissolvidas na solução de açúcar é, aproximadamente,
No preparo de certas massas culinárias, como pães, é - FUVEST 2017
Química - 2017No preparo de certas massas culinárias, como pães, é comum adicionar-se um fermento que, dependendo da receita, pode ser o químico, composto principalmente por hidrogenocarbonato de sódio (NaHCO3), ou o fermento biológico, formado por leveduras. Os fermentos adicionados, sob certas condições, são responsáveis pela produção de dióxido de carbono, o que auxilia a massa a crescer.
Para explicar a produção de dióxido de carbono, as seguintes afirmações foram feitas.
I. Tanto o fermento químico quanto o biológico reagem com os carboidratos presentes na massa culinária, sendo o dióxido de carbono um dos produtos dessa reação.
II. O hidrogenocarbonato de sódio, presente no fermento químico, pode se decompor com o aquecimento, ocorrendo a formação de carbonato de sódio (Na2CO3), água e dióxido de carbono.
III. As leveduras, que formam o fermento biológico, metabolizam os carboidratos presentes na massa culinária, produzindo, entre outras substâncias, o dióxido de carbono.
IV. Para que ambos os fermentos produzam dióxido de carbono, é necessário que a massa culinária seja aquecida a temperaturas altas (cerca de 200°C), alcançadas nos fornos domésticos e industriais.
Considere a tabela, que apresenta indicadores - UNESP 2017/2
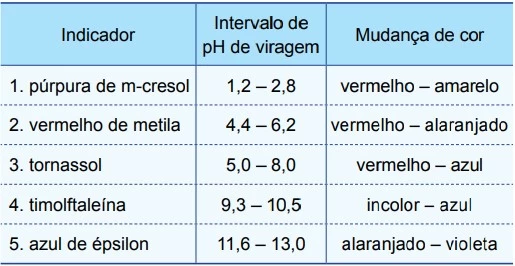
Química - 2017Considere a tabela, que apresenta indicadores ácido-base e seus respectivos intervalos de pH de viragem de cor.
O primeiro passo no metabolismo do etanol no organismo - UNESP 2017/2
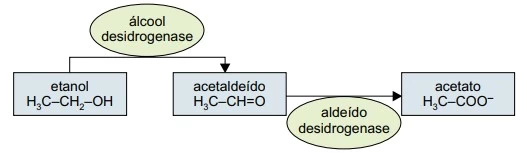
Química - 2017O primeiro passo no metabolismo do etanol no organismo humano é a sua oxidação a acetaldeído pela enzima denominada álcool desidrogenase. A enzima aldeído desidrogenase, por sua vez, converte o acetaldeído em acetato.
Um dos responsáveis pelo aroma de noz é o composto 2,5 - UNESP 2017/2
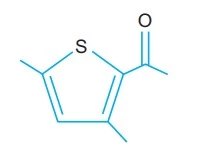
Química - 2017Um dos responsáveis pelo aroma de noz é o composto 2,5-dimetil-3-acetiltiofeno, cuja fórmula estrutural é:
Analise o quadro 1, que apresenta diferentes soluções - UNESP 2017
Química - 2017Analise o quadro 1, que apresenta diferentes soluções aquosas com a mesma concentração em mol/L e à mesma temperatura.
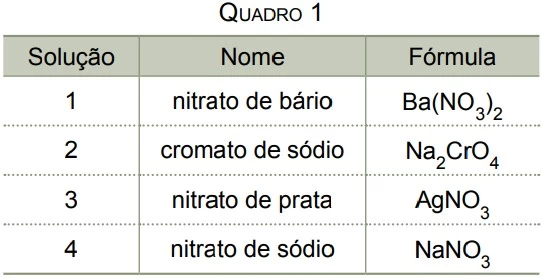
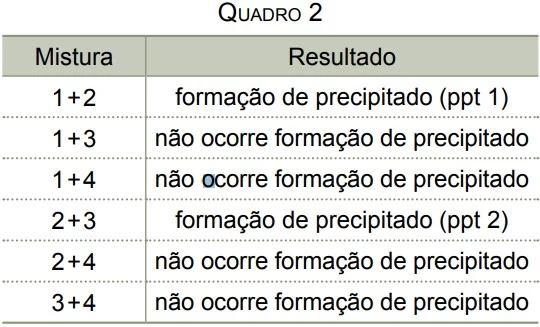
O quadro 2 apresenta o resultado das misturas, de volumes iguais, de cada duas dessas soluções.
O esquema representa um calorímetro utilizado para a - UNESP 2017
Química - 2017O esquema representa um calorímetro utilizado para a determinação do valor energético dos alimentos.
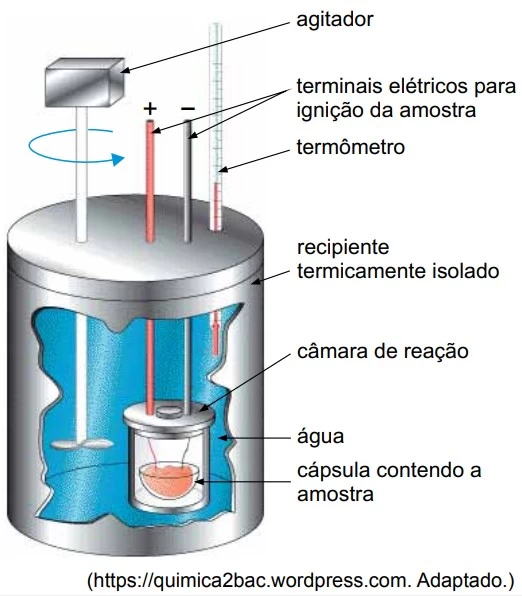
A tabela nutricional de determinado tipo de azeite de oliva traz a seguinte informação: “Uma porção de 13 mL (1 colher de sopa) equivale e 108 kcal.”
Em um experimento, um estudante realizou, nas Condições - UNESP 2017
Química - 2017Em um experimento, um estudante realizou, nas Condições Ambiente de Temperatura e Pressão (CATP), a eletrólise de uma solução aquosa de ácido sulfúrico, utilizando uma fonte de corrente elétrica contínua de 0,200 A durante 965 s.
O número total de átomos de hidrogênio presentes na - UNESP 2017
Química - 2017Leia o texto para responder às questões 72 e 73.
(www.hospitalardistribuidora.com.br)
O gluconato de cálcio (massa molar = 430 g/mol) é um medicamento destinado principalmente ao tratamento da deficiência de cálcio. Na forma de solução injetável 10%, ou seja, 100 mg/mL, este medicamento é destinado ao tratamento da hipocalcemia aguda.
(www.medicinanet.com.br. Adaptado.)
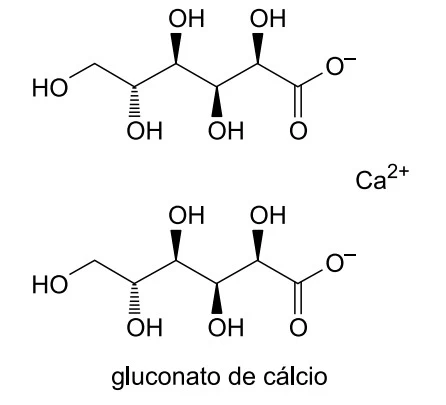
Considere que a constante de Avogadro seja - UNESP 2017
Química - 2017Leia o texto para responder às questões 72 e 73.

(www.hospitalardistribuidora.com.br)
O gluconato de cálcio (massa molar = 430 g/mol) é um medicamento destinado principalmente ao tratamento da deficiência de cálcio. Na forma de solução injetável 10%, ou seja, 100 mg/mL, este medicamento é destinado ao tratamento da hipocalcemia aguda.
(www.medicinanet.com.br. Adaptado.)

O etilbenzeno e o estireno a) são hidrocarbonetos - UNESP 2017
Química - 2017Leia o texto para responder às questões 74 e 75.
O estireno, matéria-prima indispensável para a produção do poliestireno, é obtido industrialmente pela desidrogenação catalítica do etilbenzeno, que se dá por meio do seguinte equilíbrio químico:

Analisando-se a equação de obtenção do estireno e - UNESP 2017
Química - 2017Leia o texto para responder às questões 74 e 75.
O estireno, matéria-prima indispensável para a produção do poliestireno, é obtido industrialmente pela desidrogenação catalítica do etilbenzeno, que se dá por meio do seguinte equilíbrio químico:

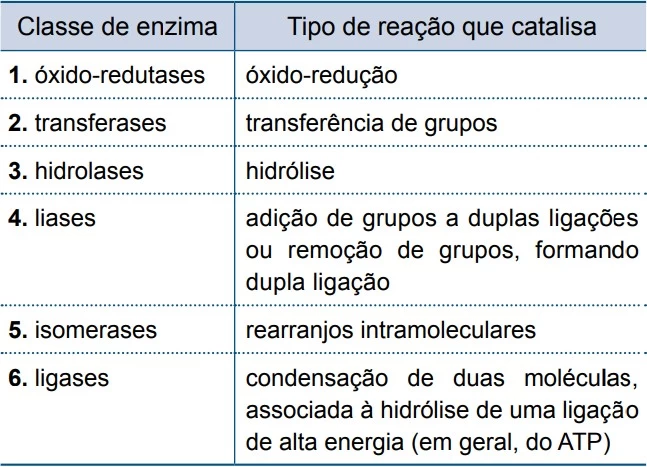
Analise o quadro, que mostra seis classes de enzimas e - UNESP 2017
Química - 2017Analise o quadro, que mostra seis classes de enzimas e os tipos de reações que catalisam.
Observando os cartões, é correto afirmar que o(a) - FATEC 2017
Química - 2017Cinco amigos estavam estudando para a prova de Química e decidiram fazer um jogo com os elementos da Tabela Periódica:
• cada participante selecionou um isótopo dos elementos da Tabela Periódica e anotou sua escolha em um cartão de papel;
• os jogadores Fernanda, Gabriela, Júlia, Paulo e Pedro decidiram que o vencedor seria aquele que apresentasse o cartão contendo o isótopo com o maior número de nêutrons.
Os cartões foram, então, mostrados pelos jogadores.

Os isótopos representados contidos nos cartões de Paulo - FATEC 2017
Química - 2017Cinco amigos estavam estudando para a prova de Química e decidiram fazer um jogo com os elementos da Tabela Periódica:
• cada participante selecionou um isótopo dos elementos da Tabela Periódica e anotou sua escolha em um cartão de papel;
• os jogadores Fernanda, Gabriela, Júlia, Paulo e Pedro decidiram que o vencedor seria aquele que apresentasse o cartão contendo o isótopo com o maior número de nêutrons.
Os cartões foram, então, mostrados pelos jogadores.

A ligação química que ocorre na combinação entre os - FATEC 2017
Química - 2017Cinco amigos estavam estudando para a prova de Química e decidiram fazer um jogo com os elementos da Tabela Periódica:
• cada participante selecionou um isótopo dos elementos da Tabela Periódica e anotou sua escolha em um cartão de papel;
• os jogadores Fernanda, Gabriela, Júlia, Paulo e Pedro decidiram que o vencedor seria aquele que apresentasse o cartão contendo o isótopo com o maior número de nêutrons.
Os cartões foram, então, mostrados pelos jogadores.

Leia o texto. Um dos piores acidentes nucleares de todos - FATEC 2017
Química - 2017Leia o texto.
Um dos piores acidentes nucleares de todos os tempos completa 30 anos em 2016. Na madrugada do dia 25 de abril, o reator número 4 da Estação Nuclear de Chernobyl explodiu, liberando uma grande quantidade de Sr-90 no meio ambiente que persiste até hoje em locais próximos ao acidente. Isso se deve ao período de meia-vida do Sr-90, que é de aproximadamente 28 anos.
O Sr-90 é um beta emissor, ou seja, emite uma partícula beta, transformando-se em Y-90. A contaminação pelo Y-90 representa um sério risco à saúde humana, pois esse elemento substitui com facilidade o cálcio dos ossos, dificultando a sua eliminação pelo corpo humano.
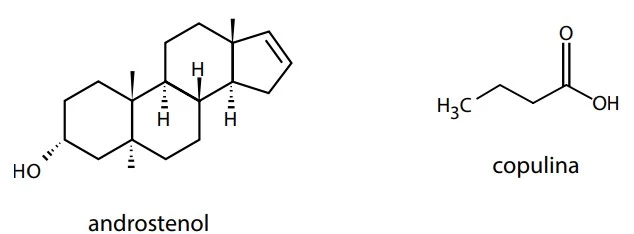
Leia o texto. Feromônios são substâncias químicas - FATEC 2017
Química - 2017Leia o texto.
Feromônios são substâncias químicas secretadas pelos indivíduos que permitem a comunicação com outros seres vivos. Nos seres humanos, há evidências de que algumas substâncias, como o androstenol e a copulina, atuam como feromônios.
http://tinyurl.com/hqfrxbb. Acesso em: 17.09.2016. Adaptado.
As fórmulas estruturais do androstenol e da copulina encontram-se representadas
No dicloroisocianurato de sódio, a porcentagem de cloro - FATEC 2017/2
Química - 2017Um vazamento de gás dentro do complexo do Porto de Santos liberou uma nuvem tóxica que atingiu duas cidades do litoral de São Paulo. A Companhia Docas do Estado de São Paulo (CODESP), responsável pela área, afirma que se trata de um vazamento do composto dicloroisocianurato de sódio (C3O3N3NaCl 2). O produto é usa do, na maioria das vezes, para a desinfecção de água, pois libera gás cloro que se dissolve na água, gerando ácido hipocloroso, que apresenta ação bactericida. Ainda de acordo com a companhia, um incêndio ocorrido posterior mente atingiu outros doze contêineres e a área foi isolada. Pouco antes, os bombeiros chegaram a afirmar que a substância que vazou tinha cheiro de amônia, mas a informação não se confirmou.
Assinale a alternativa que mostra a equação química - FATEC 2017/2
Química - 2017Um vazamento de gás dentro do complexo do Porto de Santos liberou uma nuvem tóxica que atingiu duas cidades do litoral de São Paulo. A Companhia Docas do Estado de São Paulo (CODESP), responsável pela área, afirma que se trata de um vazamento do composto dicloroisocianurato de sódio (C3O3N3NaCl 2). O produto é usa do, na maioria das vezes, para a desinfecção de água, pois libera gás cloro que se dissolve na água, gerando ácido hipocloroso, que apresenta ação bactericida. Ainda de acordo com a companhia, um incêndio ocorrido posterior mente atingiu outros doze contêineres e a área foi isolada. Pouco antes, os bombeiros chegaram a afirmar que a substância que vazou tinha cheiro de amônia, mas a informação não se confirmou.
O gás amônia se dissolve em água segundo a reação em - FATEC 2017/2
Química - 2017O gás amônia se dissolve em água segundo a reação em equilíbrio
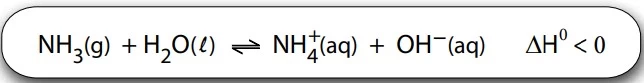
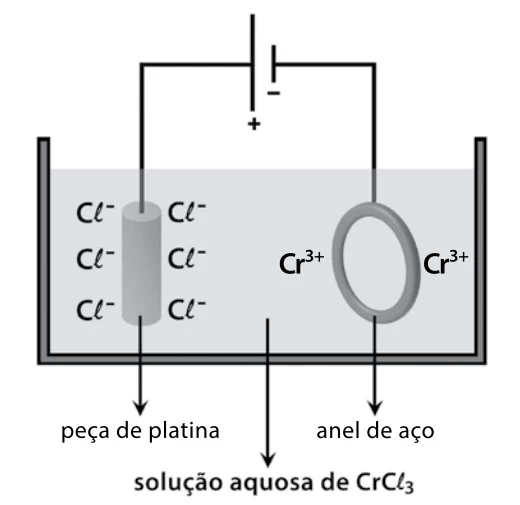
Para a cromação de um anel de aço, um estudante montou - FATEC 2017/2
Química - 2017Para a cromação de um anel de aço, um estudante montou o circuito eletrolítico representado na figura, utilizando uma fonte de corrente contínua.
As reações de eliminação são reações orgânicas em que - FATEC 2017/2
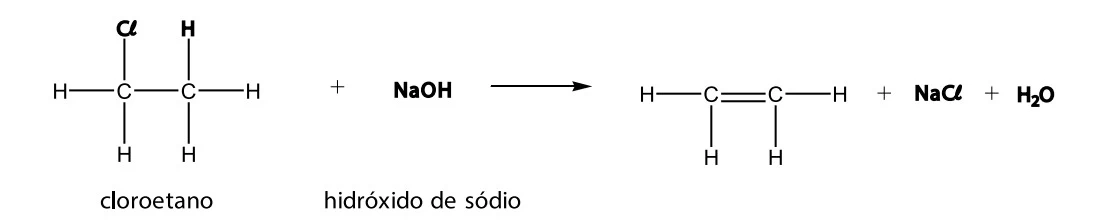
Química - 2017As reações de eliminação são reações orgânicas em que alguns átomos ou grupos de átomos são retirados de compostos orgânicos produzindo moléculas com cadeias carbônicas insaturadas, que são muito usadas em diversos ramos da indústria.
A dehidrohalogenação é um exemplo de reação de eliminação que ocorre entre um composto orgânico e uma base forte. Nesse processo químico, retira-se um átomo de halogênio ligado a um dos átomos de carbono. O átomo de carbono adjacente ao átomo de carbono halogenado “perde” um átomo de hidrogênio, estabelecendo entre os dois átomos de carbono considerados uma ligação dupla.
A reação entre o hidróxido de sódio e o cloroetano ilustrada é um exemplo de de hidrohalogenação.
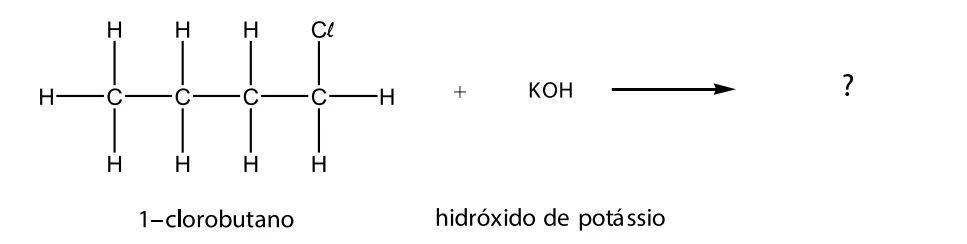
Agora, considere a reação entre o l-clorobutano e o hidróxido de potássio.
Apoie nosso trabalho!
Assine Agora