Química
Exibindo questões de 101 a 200.
Funcionamento de uma folha artificial As folhas - UNESP 2021/Prova I
Química - 2021Funcionamento de uma folha artificial
As folhas artificiais estão entre as tecnologias mais promissoras para um mundo mais limpo, pois podem tanto capturar o dióxido de carbono da atmosfera quanto transformá-lo em combustíveis limpos, além de gerar energia sob outras formas.
Essas folhas biomiméticas convertem o dióxido de carbono em combustível e decompõem a água em oxigênio e hidrogênio, tudo isso usando energia solar. Os dois processos ocorrem simultaneamente, mas um de cada lado de uma célula fotovoltaica: o oxigênio é produzido no lado “positivo” da célula e o combustível é produzido no lado “negativo”.
A partir dessas equações, pode-se prever que o ΔH - UNESP 2021/Prova I
Química - 2021Analise as equações termoquímicas.
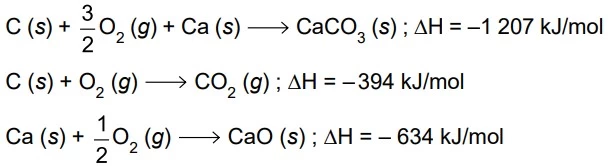
O álcool isopropílico (CH3CH(OH)CH3), entre - UNESP 2021/Prova I
Química - 2021O álcool isopropílico (CH3CH(OH)CH3), entre outras aplicações, é empregado na limpeza de circuitos eletrônicos. Em um experimento, um estudante utilizou um frasco conta-gotas com álcool isopropílico a 20ºC e verificou que eram necessárias 65 gotas desse álcool para perfazer o volume de 2 mL.
A solução aquosa de anilina é básica devido à - UNESP 2021/Prova I
Química - 2021A solução aquosa de anilina é básica devido à ocorrência do equilíbrio:
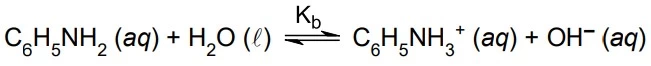
As bacteriorrizas são exemplos de associações - UNESP 2021/Prova I
Química - 2021As bacteriorrizas são exemplos de associações simbióticas entre bactérias e raízes de plantas leguminosas. Essas bactérias fixam o nitrogênio atmosférico (N2), transformando-o em amônia (NH3).
Os ácidos biliares são constituídos por moléculas - UNESP 2021/Prova I
Química - 2021Os ácidos biliares são constituídos por moléculas com porções hidrofílicas e hidrofóbicas.
Analise a fórmula estrutural. A fórmula - UNESP 2021/Prova I
Química - 2021Analise a fórmula estrutural.
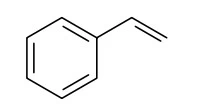
A fórmula estrutural analisada corresponde à molécula do composto que possui _____________ átomos de carbono, _____________ átomos de hidrogênio e é o monômero utilizado para a produção do polímero conhecido como _____________.
Considerando essas informações e seu conhecimento sobre - FUVEST 2021
Química - 2021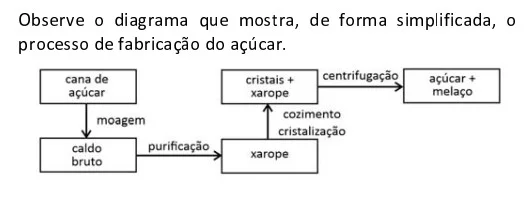
O meme acima brinca com conceitos de química em um jogo - FUVEST 2021
Química - 2021
O meme acima brinca com conceitos de química em um jogo popular, cujo objetivo é que os jogadores descubram o impostor entre os tripulantes de naves e estações espaciais. Nele um dos elementos é considerado o impostor por sua característica química diferente.
Com base nessas informações, é correto afirmar: - FUVEST 2021
Química - 2021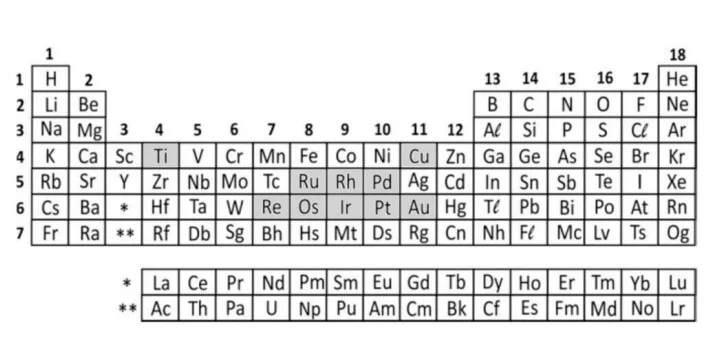
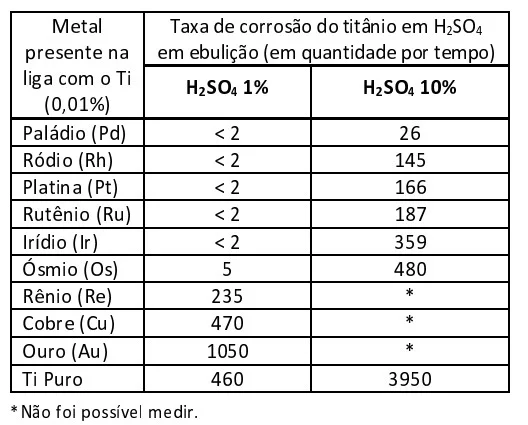
Um experimento expôs uma barra de titânio (Ti) pura e ligas desse material com 0,01% de diferentes metais nobres a soluções de ácido sulfúrico em ebulição para entender o efeito anticorrosivo desses metais no titânio. O resultado é mostrado na tabela a seguir:
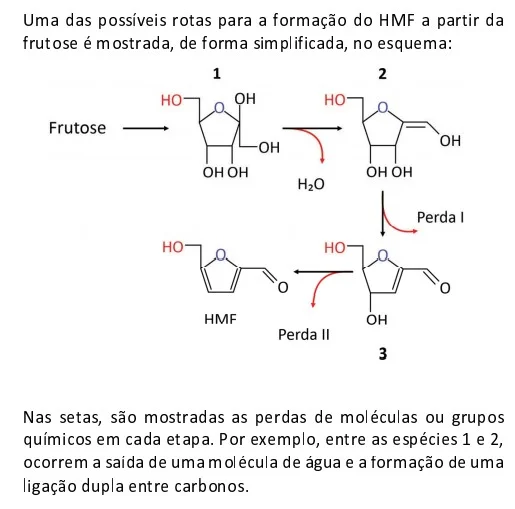
De acordo com o esquema mostrado, as perdas indicadas - FUVEST 2021
Química - 2021
Um frasco contendo 500 g de mel produzido no Brasil foi - FUVEST 2021
Química - 2021

Observe a representação a seguir, em que os círculos - FUVEST 2021
Química - 2021Observe a representação a seguir, em que os círculos brancos representam uma espécie química (molécula ou íon molecular) e os círculos coloridos, outra
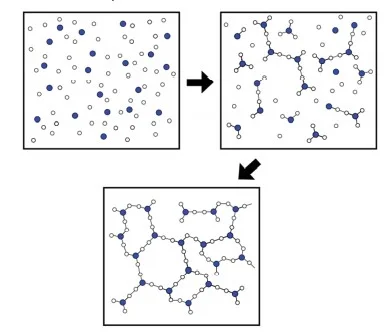
No fragmento a seguir, o autor explora conceitos químicos -FUVEST 2021
Química - 2021
Sobre os conceitos mencionados, foram feitas as seguintes afirmações:
I. A equação química mostrada na linha 2 pode ser associada à liberação de energia, pois corresponde à reação de fotossíntese com consumo de gás carbônico.
II. A equação química apresentada na linha 6 representa uma reação na qual o número de oxidação das espécies é alterado, sendo associada a corrosão.
III. O modelo incompleto referido na linha 7 refere-se ao proposto por Thomson, que identificava a presença de partículas com carga negativa dentro de uma esfera.
Para estudar equilíbrio químico de íons Co2+ em solução - FUVEST 2021
Química - 2021
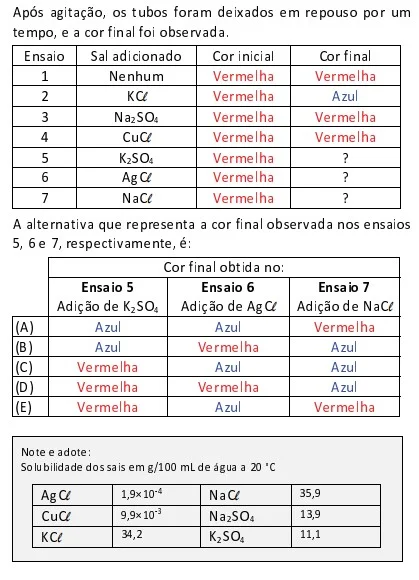
A reação de Maillard, que ocorre entre aminoácidos e - FUVEST 2021
Química - 2021A reação de Maillard, que ocorre entre aminoácidos e carboidratos redutores, é a responsável por formar espécies que geram compostos coloridos que conferem o sabor característico de diversos alimentos assados. Um exemplo é a reação entre a glicina e um carboidrato redutor mostrada na equação em que R representa uma cadeia genérica:
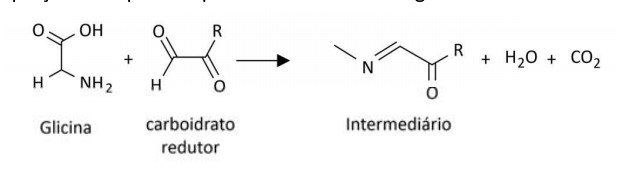
Um aminoácido específico (Composto 1), ao reagir com o carboidrato redutor, pode gerar o Composto 2, levando à formação de acrilamida, uma espécie potencialmente carcinogênica, conforme mostrado na equação:
Em aquários de água marinha, é comum o uso do equipamento -FUVEST 2021
Química - 2021
Em aquários de água marinha, é comum o uso do equipamento chamado “Skimmer”, aparato em que a água recebe uma torrente de bolhas de ar, como representado na figura, levando a matéria orgânica até a superfície, onde pode ser removida. Essa matéria orgânica eliminada é composta por moléculas orgânicas com parte apolar e parte polar, enquanto as bolhas formadas têm caráter apolar. Esse aparelho, no entanto, tem rendimento muito menor em aquários de água doce (retira menos quantidade de material orgânico por período de uso).
A destilação é um processo utilizado para separar - FUVEST 2021
Química - 2021A destilação é um processo utilizado para separar compostos presentes em uma mistura com base nas suas propriedades físicas como, por exemplo, a diferença de temperatura de ebulição, a uma dada pressão, entre os componentes da mistura.
Recentemente esse termo passou a figurar em estudos de poluição ambiental, nos quais o termo “destilação global” é utilizado para explicar a presença de compostos voláteis, como os pesticidas organoclorados, em águas e gelos de regiões polares, ainda que estes compostos nunca tenham sido produzidos ou utilizados nessas regiões.
Analise a fórmula que representa a estrutura do - UNESP 2021/Prova II
Química - 2021Analise a fórmula que representa a estrutura do gás conhecido como gás mostarda, substância capaz de causar sérias lesões na pele.
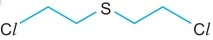
Esse gás, cuja fórmula molecular é ______________, foi empregado como arma ______________ durante a ______________ Guerra Mundial.
Folha de ouro mais fina do mundo Sunjie Ye - UNESP 2021/Prova II
Química - 2021Folha de ouro mais fina do mundo
Sunjie Ye, pesquisadora da Universidade de Leeds, no Reino Unido, chegou muito perto do ouro monoatômico: ela criou uma folha de ouro com espessura equivalente ao diâmetro de apenas dois átomos desse elemento.
A quase monocamada de ouro mede 0,47 nanômetro de espessura, a mais fina camada de ouro já fabricada sem um suporte; falta apenas o equivalente ao diâmetro de um átomo para chegar à camada de ouro mais fina possível — que provavelmente se chamará oureno, quando sintetizada.
Analise as reações. Reação 1 – Obtenção de água - UNESP 2021/Prova II
Química - 2021Analise as reações.

Quando se comparam volumes iguais de biogás e - UNESP 2021/Prova II
Química - 2021Leia o texto para responder às questões 72 e 73.
Por que o biogás é uma opção de energia renovável?
O biogás é um biocombustível gasoso produzido a partir da decomposição da matéria orgânica por bactérias fermentadoras, em um processo chamado biodegradação anaeróbia, isto é, o processo ocorre na ausência de oxigênio. Nesse processo, produz-se um gás rico em metano (de 40% a 80% de sua composição, sendo o resto dióxido de carbono e pequenas quantidades de hidrogênio, nitrogênio, amônia, ácido sulfídrico, entre outros). Para gerar energia elétrica usando biogás, utiliza-se a conversão da energia química do gás em energia mecânica, por meio de um processo controlado de combustão, que ativa um gerador. O biogás também pode ser purificado para a geração de biometano, que é equivalente ao gás natural veicular.
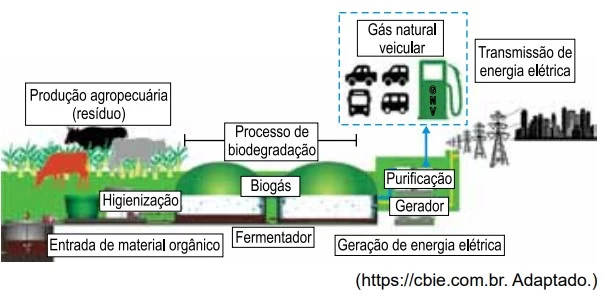
A tabela a seguir compara as composições químicas médias dos principais componentes do biogás e do biometano.

Para a obtenção de biometano a partir do biogás - UNESP 2021/Prova II
Química - 2021Leia o texto para responder às questões 72 e 73.
Por que o biogás é uma opção de energia renovável?
O biogás é um biocombustível gasoso produzido a partir da decomposição da matéria orgânica por bactérias fermentadoras, em um processo chamado biodegradação anaeróbia, isto é, o processo ocorre na ausência de oxigênio. Nesse processo, produz-se um gás rico em metano (de 40% a 80% de sua composição, sendo o resto dióxido de carbono e pequenas quantidades de hidrogênio, nitrogênio, amônia, ácido sulfídrico, entre outros). Para gerar energia elétrica usando biogás, utiliza-se a conversão da energia química do gás em energia mecânica, por meio de um processo controlado de combustão, que ativa um gerador. O biogás também pode ser purificado para a geração de biometano, que é equivalente ao gás natural veicular.

A tabela a seguir compara as composições químicas médias dos principais componentes do biogás e do biometano.

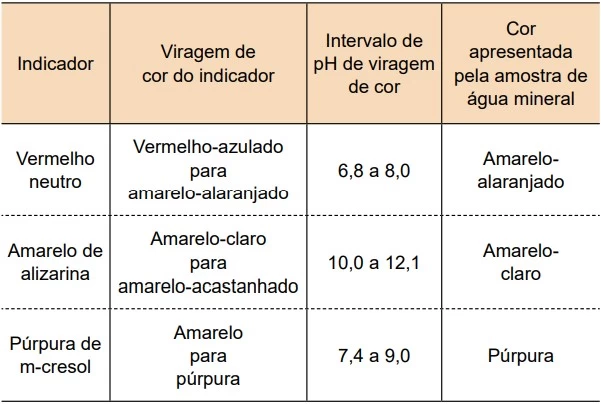
Uma amostra de água mineral natural a 25°C foi - UNESP 2021/Prova II
Química - 2021Uma amostra de água mineral natural a 25°C foi testada com três indicadores ácido-base. Os resultados desse teste estão indicados na última coluna da tabela.
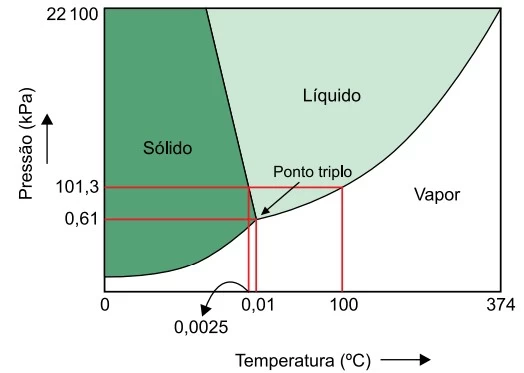
Analise o diagrama, que representa as fases da - UNESP 2021/Prova II
Química - 2021Analise o diagrama, que representa as fases da água conforme as condições de pressão e temperatura.
Um professor de química fez uma demonstração em - UNESP 2021/Prova II
Química - 2021Um professor de química fez uma demonstração em que produziu hidrogênio gasoso (H2) pela reação, a quente, de ácido clorídrico (HCl) com 6,75 g de alumínio sólido (Al) sob forma de folhas amassadas.
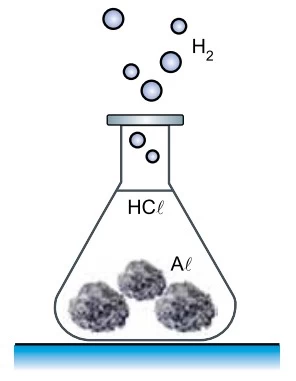
A equação que representa essa reação é:

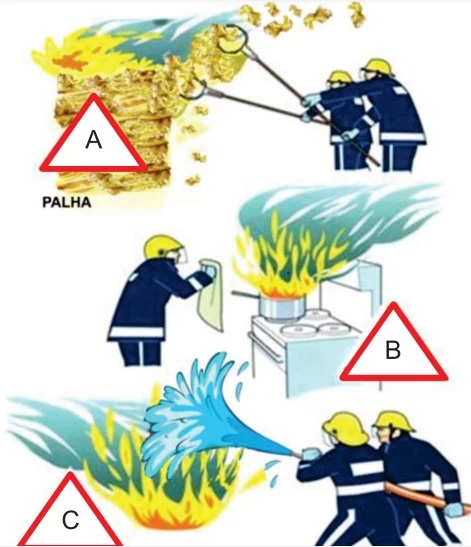
O Brasil ardeu em chamas em 2020. Muitas soluções foram - UNICAMP 2021
Química - 2021O Brasil ardeu em chamas em 2020. Muitas soluções foram propostas, incluindo o uso do “boi bombeiro”, porém nem todas eliminam de fato um dos três componentes que mantêm o fogo: calor, combustível e comburente. A figura a seguir representa três ações de bombeiros para extinguir o fogo.
É comum encontrarmos, nos supermercados, produtos - UNICMAP 2021
Química - 2021É comum encontrarmos, nos supermercados, produtos semelhantes em suas finalidades, porém em quantidades, concentrações de ingredientes e preços bem variados. Imagine três produtos com propriedades desinfetantes, com o mesmo princípio ativo. Os produtos têm as seguintes características:
Produto A: 0,45% (massa/massa) do princípio ativo, conteúdo de 1 L, valor R$ 11,90;
Produto B: 0,17% (massa/massa) do princípio ativo, conteúdo de 0,5 L, valor R$ 2,49;
Produto C: 0,33% (massa/massa) do princípio ativo, conteúdo de 2 L, valor R$ 5,19.
A calagem é uma prática de manejo do solo que consiste - UNICAMP 2021
Química - 2021Em 2020, o Brasil foi impactado com a notícia de que - UNICAMP 2021
Química - 2021Em 2020, o Brasil foi impactado com a notícia de que muitas pessoas haviam se contaminado ao ingerir cerveja. Como se apurou mais tarde, a bebida havia sido conta - minada por dietilenoglicol. O fabricante argumentou que havia comprado monoetilenoglicol, e que o dietilenoglicol chegou ao produto por contaminação ou por engano.
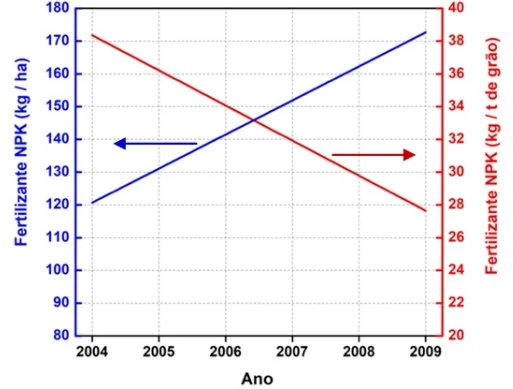
A figura a seguir mostra uma das formas de se - UNICAMP 2021
Química - 2021A figura a seguir mostra uma das formas de se contabilizar as tendências no uso de fertilizantes por hectare e por tonelada de grão em uma fazenda no Brasil em determinado período. A partir desse tipo de informação pode-se saber, por exemplo, como a prática agrícola de um sistema de cultivo está influenciando o uso de nutrientes e a produtividade do solo para o cultivo.
A remoção de sulfeto de hidrogênio presente em amostras - UNICAMP 2021
Química - 2021A remoção de sulfeto de hidrogênio presente em amostras de biogás é essencial, já que ele é altamente corrosivo para tubulações metálicas. A queima desse H2S também é muito prejudicial ao meio ambiente, pois leva à formação de dióxido de enxofre. Um estudo de 2014 sugere que a remoção do H2S pode ser realizada pelo uso de esponjas de óxido de ferro, que reage com esse gás, mas pode ser regenerado. Segundo o estudo, no dispositivo utilizado, 1,00 kg de óxido de ferro foi capaz de remover entre 0,200 e 0,716 kg de sulfeto de hidrogênio. Considere que apenas a reação abaixo equacionada esteja ocorrendo nessa remoção.
Fe2O3(s) + 3 H2S(g) → Fe2S3(s) + 3 H2O(l)
“Hospital Municipal de Juruti (PA) recebe mais de 70 - UNICAMP 2021
Química - 2021“Hospital Municipal de Juruti (PA) recebe mais de 70 cilindros de oxigênio para tratar pacientes com Covid-19” (site G1, 01/06/2020). A oxigenoterapia é indicada para todos os pacientes graves, inicialmente variando de 5 a 10 L de O2/min.
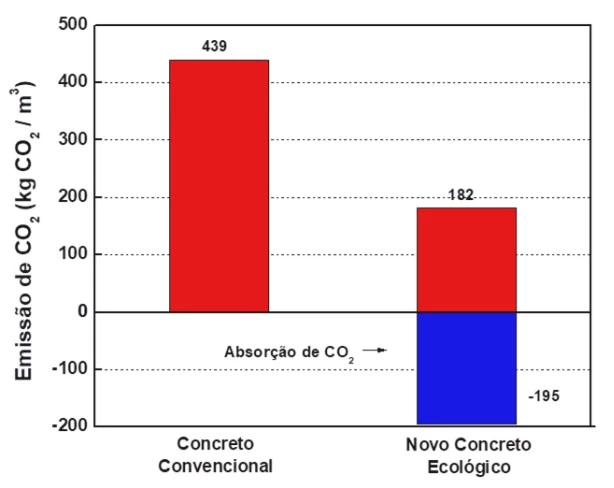
Um estudo científico desenvolveu um novo concreto - UNICAMP 2021
Química - 2021Um estudo científico desenvolveu um novo concreto ecológico capaz de alcançar uma emissão de CO2 a um nível abaixo de zero. Esse material é composto de uma mistura especial à base de um silicato duplo de cálcio, em vez de cimento. Além de sua produção apresentar baixa emissão de CO2, o endurecimento do concreto ocorre pela absorção de CO2. Esse processo de endurecimento, apesar de lento quando realizado na atmosfera, pode ser acelerado ao se capturar o gás numa usina térmica de energia, por exemplo. Também observou-se que a absorção de NOx e SOx pode diminuir a absorção de CO2.
Lâmpadas de neon são tubos contendo gases rarefeitos - FAMERP 2021
Química - 2021Lâmpadas de neon são tubos contendo gases rarefeitos submetidos a uma diferença de potencial. Quando elétrons percorrem o tubo, colidem com as moléculas do gás e emitem luz com cor característica do elemento químico, conforme ilustra a figura.

A natureza das ligações intermoleculares define as - FAMERP 2021
Química - 2021A natureza das ligações intermoleculares define as propriedades das substâncias.
O oxigênio é o produto gasoso da reação de decomposição - FAMERP 2021
Química - 2021O oxigênio é o produto gasoso da reação de decomposição do clorato de potássio (KClO3), de acordo com a equação:
2KClO3 → 2KCl + 3O2
Amostras das substâncias cloreto de potássio (KCl) - FAMERP 2021
Química - 2021Amostras das substâncias cloreto de potássio (KCl), cloreto de amônio (NH4Cl), clorofórmio (CHCl3) e sacarose (C12H22O11) foram colocadas, separadamente e não necessariamente nessa ordem, em quatro tubos de ensaio contendo água, identificados de 1 a 4. Cada sistema formado foi submetido a testes de condutividade elétrica e pH. Os resultados foram reunidos na tabela a seguir.

A mistura de 100 mL de uma solução de HCl, de - FAMERP 2021
Química - 2021A mistura de 100 mL de uma solução de HCl, de concentração 2 x 10–2 mol/L, com 400 mL de uma solução de NaOH, de concentração 6,25 x 10–3 mol/L, gera uma solução de caráter
O etanol (C2H6O) pode ser produzido em laboratório por - FAMERP 2021
Química - 2021O etanol (C2H6O) pode ser produzido em laboratório por meio da hidratação do etileno (C2H4), conforme a equação:
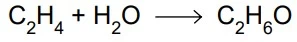
A entalpia dessa reação pode ser calculada por meio da Lei de Hess, utilizando-se as equações:
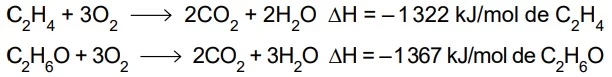
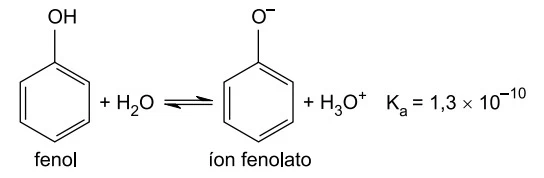
O fenol é uma substância de caráter ácido, que sofre - FAMERP 2021
Química - 2021O fenol é uma substância de caráter ácido, que sofre ionização de acordo com a equação a seguir.
Considerando x um dos compostos químicos presentes nas - FAMERP 2021
Química - 2021Considere as equações químicas:
O iodo é um elemento relativamente raro, cuja forma - FAMERP 2021
Química - 2021O iodo é um elemento relativamente raro, cuja forma elementar (I2) é produzida a partir de suas espécies iônicas encontradas na natureza. As algas marinhas e as águas-mães do processamento do salitre do Chile são fontes naturais de íons iodeto (I–) e iodato (IO-3), respectivamente. A conversão desses íons em iodo molecular ocorre de acordo com as equações 1 e 2.
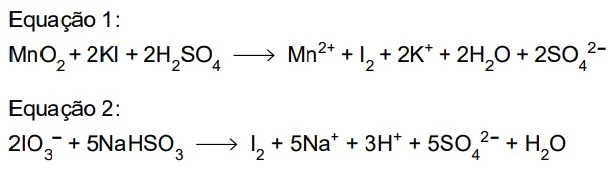
A substância que consome a menor quantidade de oxigênio - FAMERP 2021
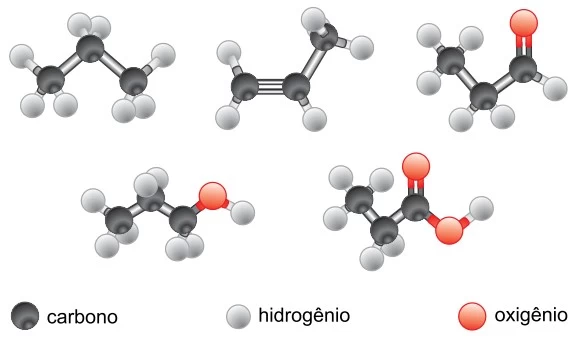
Química - 2021Considere as substâncias a seguir.
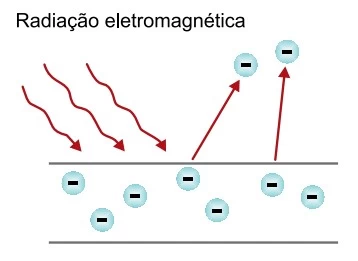
As fotocélulas são dispositivos utilizados como - FAMERP 2020
Química - 2020As fotocélulas são dispositivos utilizados como substitutos de interruptores que acendem as lâmpadas de uma casa ou de postes na rua. Esses dispositivos baseiam seu funcionamento no efeito fotoelétrico, como ilustra a figura.
Um resíduo de 200 mL de solução de ácido sulfúrico - FAMERP 2020
Química - 2020Um resíduo de 200 mL de solução de ácido sulfúrico (H2SO4), de concentração 0,1 mol/L, precisava ser neutralizado antes do descarte. Para tanto, foi utilizado bicarbonato de sódio (NaHCO3), conforme a equação a seguir:
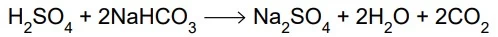
Considere a tabela, que apresenta propriedades físicas - FAMERP 2020
Química - 2020Considere a tabela, que apresenta propriedades físicas das substâncias I, II, III e IV.
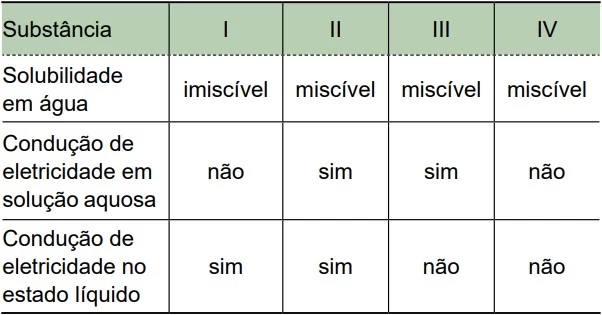
O óxido de propileno é uma substância utilizada na - FAMERP 2020
Química - 2020O óxido de propileno é uma substância utilizada na produção de polímeros, como o poliuretano. Sua fórmula estrutural está representada a seguir.
A tabela apresenta as pressões de vapor, à mesma - FAMERP 2020
Química - 2020A tabela apresenta as pressões de vapor, à mesma temperatura, de três substâncias polares I, II e III.

Uma solução de hidróxido de sódio (NaOH) apresenta pH - FAMERP 2020
Química - 2020Uma solução de hidróxido de sódio (NaOH) apresenta pH igual a 9. Considerando-se o valor de Kw igual a 10–14, a concentração de íons OH– nessa solução é igual a
A decomposição térmica do carbonato de zinco (ZnCO3) em - FAMERP 2020
Química - 2020A decomposição térmica do carbonato de zinco (ZnCO3) em seus óxidos tem uma entalpia positiva de 71,5 kJ/mol de ZnCO3.
A figura representa uma célula galvânica constituída por - FAMERP 2020
Química - 2020A figura representa uma célula galvânica constituída por um eletrodo padrão de hidrogênio mergulhado em uma solução com [H+] = 1,0 mol/L e por um eletrodo de ouro mergulhado em solução contendo íons Fe2+ e íons Fe3+.
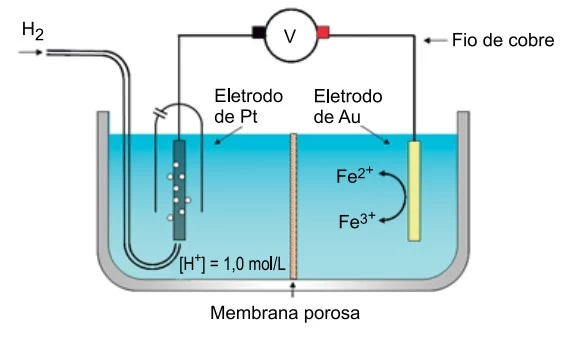
(https://mycourses.aalto.fi. Adaptado.)
Considere os eletrodos de platina e de ouro inertes e os potenciais de redução das espécies químicas presentes nas soluções:
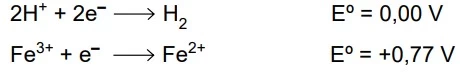
O urânio-235, ao ser bombardeado por um nêutron, forma - FAMERP 2020
Química - 2020O urânio-235, ao ser bombardeado por um nêutron 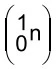 , forma dois nuclídeos radioativos: o bário-144, que decai emitindo partículas beta
, forma dois nuclídeos radioativos: o bário-144, que decai emitindo partículas beta 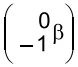 , e o nuclídeo X. Esse bombardeamento produz também três nêutrons, que colidirão com outros núcleos de urânio, causando uma reação em cadeia.
, e o nuclídeo X. Esse bombardeamento produz também três nêutrons, que colidirão com outros núcleos de urânio, causando uma reação em cadeia.
Um hidrocarboneto insaturado, ao sofrer oxidação com - FAMERP 2020
Química - 2020Um hidrocarboneto insaturado, ao sofrer oxidação com permanganato de potássio em meio ácido, produziu três compostos diferentes, conforme a equação:
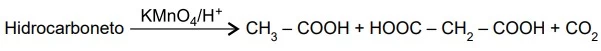
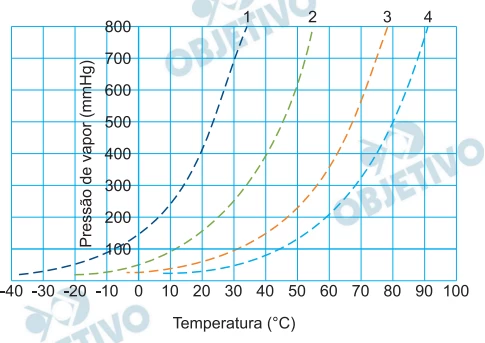
As curvas apresentadas no gráfico foram construídas com - FGV 2020
Química - 2020As curvas apresentadas no gráfico foram construídas com dados obtidos em uma pesquisa experimental que monitorou o comportamento da pressão de vapor dos líquidos 1, 2, 3 e 4 em função da temperatura.
A argentita é um minério de prata no qual o cátion - FGV 2020
Química - 2020A argentita é um minério de prata no qual o cátion monovalente do metal nobre encontra-se ligado ao ânion sulfeto.
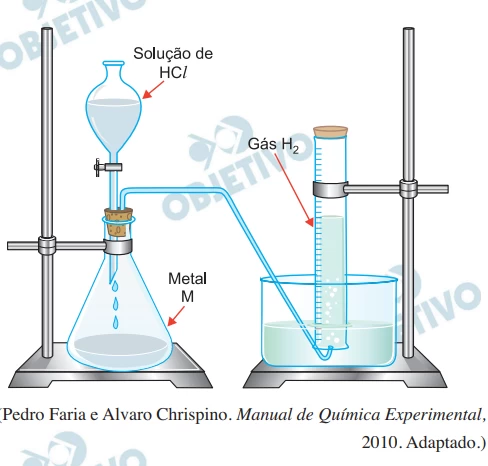
Um experimento para a identificação de um metal M foi - FGV 2020
Química - 2020Um experimento para a identificação de um metal M foi realizado de acordo com a montagem instrumental da figura.
O Bioglass® é um vidro que apresenta a característica de - FGV 2020
Química - 2020O Bioglass® é um vidro que apresenta a característica de se ligar fortemente ao tecido ósseo e, devido a essa propriedade, é muito empregado em implantes.
Esse material é sintetizado a partir dos seguintes óxidos: dióxido de silício, óxido de cálcio, óxido de sódio e pentóxido de difósforo.
Uma granada de fumaça contém 6 mol de cada um dos reagentes - FGV 2020
Química - 2020Granadas de fumaça são dispositivos usados pelas forças armadas em situações de combate, com o objetivo de ocultar a movimentação das tropas. Nesses dispositivos, os reagentes hexacloroetano (C2Cl 6), alumínio em pó (Al) e óxido de zinco (ZnO) ficam em compartimentos separados e, quando o detonador é acionado, ocorre a mistura desses reagentes, provocando uma sequência de duas reações instantâneas, representadas pelas seguintes equações:
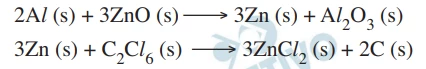
A fumaça produzida pela detonação da granada é quimicamente - FGV 2020
Química - 2020Granadas de fumaça são dispositivos usados pelas forças armadas em situações de combate, com o objetivo de ocultar a movimentação das tropas. Nesses dispositivos, os reagentes hexacloroetano (C2Cl 6), alumínio em pó (Al) e óxido de zinco (ZnO) ficam em compartimentos separados e, quando o detonador é acionado, ocorre a mistura desses reagentes, provocando uma sequência de duas reações instantâneas, representadas pelas seguintes equações:
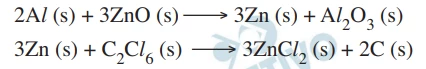
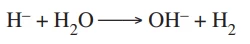
O ânion hidreto (H–) forma o hidreto de sódio (NaH), - FGV 2020
Química - 2020O ânion hidreto (H–) forma o hidreto de sódio (NaH), composto empregado no estudo do mecanismo de reações químicas, por ser um forte agente redutor. O íon hidreto reage violentamente com a água, formando o gás hidrogênio (H2), como representa a equação da reação:
A furaltadona (C13H16N4O6) é uma substância bactericida - FGV 2020
Química - 2020A furaltadona (C13H16N4O6) é uma substância bactericida empregada no combate à salmonela, sendo adicionada à água de bebedouros em criadouros de aves. A furaltadona interage com a água de acordo com a reação representada pela equação:
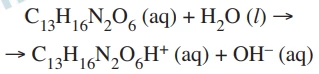
O composto digluconato de clorexidina (DGC) possui massa - FGV 2020
Química - 2020O composto digluconato de clorexidina (DGC) possui massa molar igual a 505,5 g/mol e é o princípio ativo em soluções destinadas à assepsia e esterilização das mãos em procedimentos cirúrgicos. Uma solução alcoólica comercial desse composto contém 0,5% em massa de DGC e sua densidade é igual a 1,0 g/mL.
Uma cozinheira preparou um molho de tomate para ser - FGV 2020
Química - 2020Uma cozinheira preparou um molho de tomate para ser consumido posteriormente, armazenando-o no refrigerador, em um recipiente de aço inoxidável coberto com uma folha de alumínio, conforme mostram as imagens.

Em outubro de 2017 diversos países europeus reportaram - FGV 2020
Química - 2020Em outubro de 2017 diversos países europeus reportaram detecções da presença anormal do radiosótopo rutênio-106 (106Ru) no ar atmosférico. Esse fato foi atribuído a um acidente nuclear que ocorreu na Rússia. A radioatividade referente a esse radioisótopo, medida na atmosfera, foi de 100 mBq/m3. O radioisótopo rutênio-106 decai com emissão de partículas β– com tempo de meia-vida igual a 1 ano.
Na estrutura da molécula do Malathion®, o átomo que - FGV 2020
Química - 2020Entre os diversos defensivos químicos empregados na agricultura estão o Malathion® e o florpirauxifen-benzil. Suas fórmulas estruturais estão representadas a seguir.

Na estrutura da molécula do florpirauxifen-benzil estão - FGV 2020
Química - 2020Entre os diversos defensivos químicos empregados na agricultura estão o Malathion® e o florpirauxifen-benzil. Suas fórmulas estruturais estão representadas a seguir.

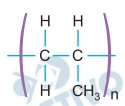
Diversos polímeros, como o polietileno, o teflon e o PVC, - FGV 2020
Química - 2020Diversos polímeros, como o polietileno, o teflon e o PVC, são produzidos pelo mesmo tipo de reação de polimerização. Esses polímeros são empregados na fabricação de embalagens e em diversas finalidades em en genharia. A fórmula estrutural de um polímero reciclável dessa classe está representada a seguir.
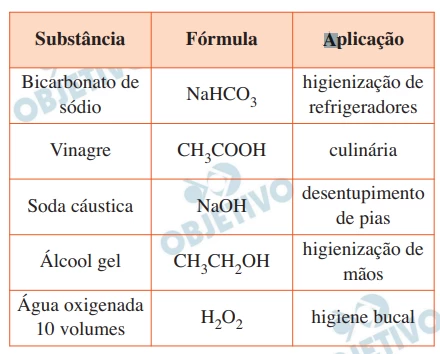
A tabela apresenta algumas substâncias químicas muito utili - FGV 2020
Química - 2020A tabela apresenta algumas substâncias químicas muito utilizadas em nosso cotidiano.
Uma das áreas de aplicação dos conhecimentos de - FATEC 2023
Química - 2020Uma das áreas de aplicação dos conhecimentos de biotecnologia no mercado de trabalho é a produção de alimentos, bebidas e biocombustíveis que utilizam microorganismos em sua fabricação. Nesse contexto, um dos processos utilizados é a fermentação de carboidratos. A equação química que representa a reação que ocorre na fermentação alcoólica da glicose é
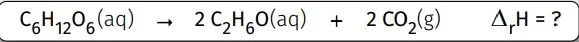
Pesquisadores conseguiram controlar reações químicas - FUVEST 2020
Química - 2020
Pesquisadores (...) conseguiram controlar reações químicas de um modo inovador. Usaram feixes de laser para promover um esbarrão entre dois átomos e uni-los, criando uma molécula. Utilizando pinças ópticas (feixes de laser altamente focados capazes de aprisionar objetos microscópicos), os pesquisadores empurraram um átomo do elemento químico césio (Cs) contra um átomo de sódio (Na) até que colidissem. Um terceiro laser foi lançado sobre ambos, fornecendo energia extra para criar a molécula NaCs. Na natureza, as moléculas formam-se a partir da interação de átomos por acaso. Por suas características químicas, césio e sódio jamais originariam uma molécula espontaneamente. (...)
Considerando que uma colher de chá de bicarbonato de - FATEC 2023
Química - 2020A Química do Slime
A jornada histórica do slime tem início nas primeiras décadas do século XX, quando James Wright criou um material com características muito parecidas com a borracha. Atualmente, devido às mais variadas formulações disponibilizadas em plataformas e mídias digitais, pode-se produzir o próprio slime em casa.
O slime caseiro pode ser produzido pela mistura de duas colheres de chá de bicarbonato de sódio (NaHCO3), 100 mL de água boricada (solução de ácido bórico, H3BO3) e 60 g de cola de isopor (constituída de poliacetato de vinila, PVAc). Quando misturamos o bicarbonato de sódio com o ácido bórico, ocorre uma reação química que produz gás carbônico, água e borato de sódio (Na3BO3).
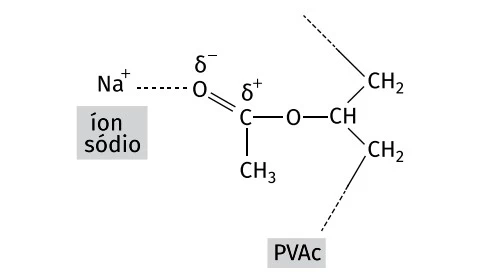
A dissociação, em solução aquosa, do borato e do bicarbonato de sódio libera íons sódio (Na+), que vão interagir com as moléculas do PVAc, formando um composto de elevada viscosidade e elasticidade.
Os íons sódio interagem com a estrutura do PVAc conforme representado.
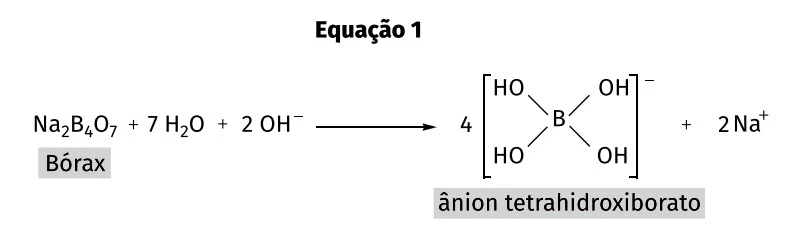
A reação entre o ácido bórico e o bicarbonato de sódio também origina o tetraborato de sódio, conhecido como “Bórax” (Na2B4O7). Este, em meio básico, transforma-se em tetrahidroxiborato, conforme representado na equação 1.
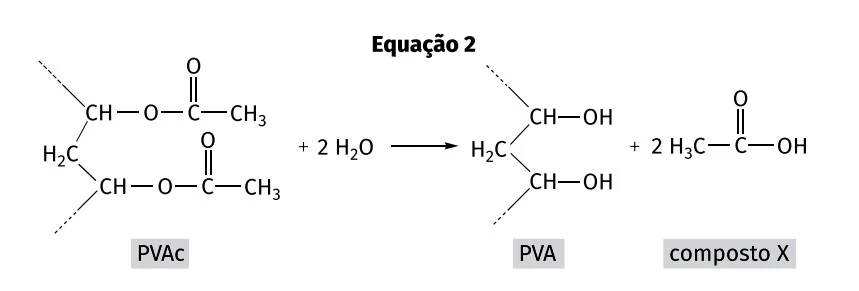
O PVAc reage com moléculas de água produzindo álcool polivinílico (PVA), conforme representado na equação 2.
O tetrahidroxiborato reage com o PVA (equação 3), formando novas ligações que interligam as cadeias do polímero que constitui o slime.
Assinale a alternativa que contém a equação química - FATEC 2023
Química - 2020A Química do Slime
A jornada histórica do slime tem início nas primeiras décadas do século XX, quando James Wright criou um material com características muito parecidas com a borracha. Atualmente, devido às mais variadas formulações disponibilizadas em plataformas e mídias digitais, pode-se produzir o próprio slime em casa.
O slime caseiro pode ser produzido pela mistura de duas colheres de chá de bicarbonato de sódio (NaHCO3), 100 mL de água boricada (solução de ácido bórico, H3BO3) e 60 g de cola de isopor (constituída de poliacetato de vinila, PVAc). Quando misturamos o bicarbonato de sódio com o ácido bórico, ocorre uma reação química que produz gás carbônico, água e borato de sódio (Na3BO3).
A dissociação, em solução aquosa, do borato e do bicarbonato de sódio libera íons sódio (Na+), que vão interagir com as moléculas do PVAc, formando um composto de elevada viscosidade e elasticidade.
Os íons sódio interagem com a estrutura do PVAc conforme representado.

A reação entre o ácido bórico e o bicarbonato de sódio também origina o tetraborato de sódio, conhecido como “Bórax” (Na2B4O7). Este, em meio básico, transforma-se em tetrahidroxiborato, conforme representado na equação 1.

O PVAc reage com moléculas de água produzindo álcool polivinílico (PVA), conforme representado na equação 2.

O tetrahidroxiborato reage com o PVA (equação 3), formando novas ligações que interligam as cadeias do polímero que constitui o slime.

A interação entre os íons sódio e as estruturas do PVAc é - FATEC 2023
Química - 2020A Química do Slime
A jornada histórica do slime tem início nas primeiras décadas do século XX, quando James Wright criou um material com características muito parecidas com a borracha. Atualmente, devido às mais variadas formulações disponibilizadas em plataformas e mídias digitais, pode-se produzir o próprio slime em casa.
O slime caseiro pode ser produzido pela mistura de duas colheres de chá de bicarbonato de sódio (NaHCO3), 100 mL de água boricada (solução de ácido bórico, H3BO3) e 60 g de cola de isopor (constituída de poliacetato de vinila, PVAc). Quando misturamos o bicarbonato de sódio com o ácido bórico, ocorre uma reação química que produz gás carbônico, água e borato de sódio (Na3BO3).
A dissociação, em solução aquosa, do borato e do bicarbonato de sódio libera íons sódio (Na+), que vão interagir com as moléculas do PVAc, formando um composto de elevada viscosidade e elasticidade.
Os íons sódio interagem com a estrutura do PVAc conforme representado.

A reação entre o ácido bórico e o bicarbonato de sódio também origina o tetraborato de sódio, conhecido como “Bórax” (Na2B4O7). Este, em meio básico, transforma-se em tetrahidroxiborato, conforme representado na equação 1.

O PVAc reage com moléculas de água produzindo álcool polivinílico (PVA), conforme representado na equação 2.

O tetrahidroxiborato reage com o PVA (equação 3), formando novas ligações que interligam as cadeias do polímero que constitui o slime.

Na equação 2, o nome da reação química que ocorre entre - FATEC 2023
Química - 2020A Química do Slime
A jornada histórica do slime tem início nas primeiras décadas do século XX, quando James Wright criou um material com características muito parecidas com a borracha. Atualmente, devido às mais variadas formulações disponibilizadas em plataformas e mídias digitais, pode-se produzir o próprio slime em casa.
O slime caseiro pode ser produzido pela mistura de duas colheres de chá de bicarbonato de sódio (NaHCO3), 100 mL de água boricada (solução de ácido bórico, H3BO3) e 60 g de cola de isopor (constituída de poliacetato de vinila, PVAc). Quando misturamos o bicarbonato de sódio com o ácido bórico, ocorre uma reação química que produz gás carbônico, água e borato de sódio (Na3BO3).
A dissociação, em solução aquosa, do borato e do bicarbonato de sódio libera íons sódio (Na+), que vão interagir com as moléculas do PVAc, formando um composto de elevada viscosidade e elasticidade.
Os íons sódio interagem com a estrutura do PVAc conforme representado.

A reação entre o ácido bórico e o bicarbonato de sódio também origina o tetraborato de sódio, conhecido como “Bórax” (Na2B4O7). Este, em meio básico, transforma-se em tetrahidroxiborato, conforme representado na equação 1.

O PVAc reage com moléculas de água produzindo álcool polivinílico (PVA), conforme representado na equação 2.

O tetrahidroxiborato reage com o PVA (equação 3), formando novas ligações que interligam as cadeias do polímero que constitui o slime.

Na equação 3, as ligações químicas I, II, III e IV, forma - FATEC 2023
Química - 2020A Química do Slime
A jornada histórica do slime tem início nas primeiras décadas do século XX, quando James Wright criou um material com características muito parecidas com a borracha. Atualmente, devido às mais variadas formulações disponibilizadas em plataformas e mídias digitais, pode-se produzir o próprio slime em casa.
O slime caseiro pode ser produzido pela mistura de duas colheres de chá de bicarbonato de sódio (NaHCO3), 100 mL de água boricada (solução de ácido bórico, H3BO3) e 60 g de cola de isopor (constituída de poliacetato de vinila, PVAc). Quando misturamos o bicarbonato de sódio com o ácido bórico, ocorre uma reação química que produz gás carbônico, água e borato de sódio (Na3BO3).
A dissociação, em solução aquosa, do borato e do bicarbonato de sódio libera íons sódio (Na+), que vão interagir com as moléculas do PVAc, formando um composto de elevada viscosidade e elasticidade.
Os íons sódio interagem com a estrutura do PVAc conforme representado.

A reação entre o ácido bórico e o bicarbonato de sódio também origina o tetraborato de sódio, conhecido como “Bórax” (Na2B4O7). Este, em meio básico, transforma-se em tetrahidroxiborato, conforme representado na equação 1.

O PVAc reage com moléculas de água produzindo álcool polivinílico (PVA), conforme representado na equação 2.

O tetrahidroxiborato reage com o PVA (equação 3), formando novas ligações que interligam as cadeias do polímero que constitui o slime.

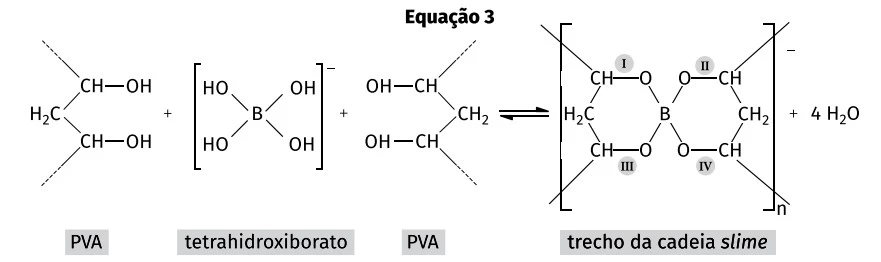
Ao se preparar molho de tomate (considere apenas a fervura de - FUVEST
Química - 2020Ao se preparar molho de tomate (considere apenas a fervura de tomate batido com água e azeite), é possível observar que a fração aquosa (fase inferior) fica vermelha logo no início e a fração oleosa (fase superior), inicialmente com a cor característica do azeite, começa a ficar avermelhada conforme o preparo do molho. Por outro lado, ao se preparar uma sopa de beterraba (considere apenas a fervura de beterraba batida com água e azeite), a fração aquosa (fase inferior) fica com a cor rosada e a fração oleosa (fase superior) permanece com sua coloração típica durante todo o processo, não tendo sua cor alterada.
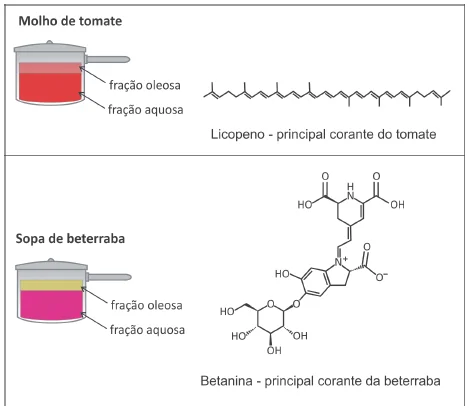

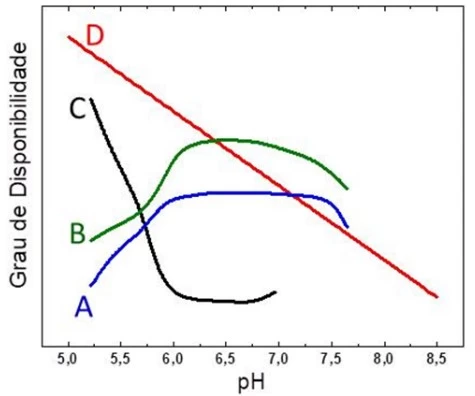
Um estudante coletou informações sobre a concentração - UNESP 2020
Química - 2020Um estudante coletou informações sobre a concentração total de sais dissolvidos, expressa em diferentes unidades de medida, de quatro amostras de águas naturais de diferentes regiões. Com os dados obtidos, preparou a seguinte tabela:
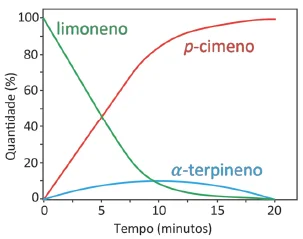
Numa determinada condição experimental e com o catalisador-FUVEST 2020
Química - 2020Numa determinada condição experimental e com o catalisador adequado, ocorre uma reação, conforme representada no gráfico, que relaciona porcentagem do composto pelo tempo de reação.
O Parque Eólico de Osório é o maior da América Latina - UNESP 2020
Química - 2020Parque Eólico de Osório, RS

O Parque Eólico de Osório é o maior da América Latina e o segundo maior do mundo em operação. Com capacidade produtiva total de 150 MW, tem potência suficiente para abastecer anualmente o consumo residencial de energia elétrica de cerca de 650 mil pessoas.
(www.osorio.rs.gov.br. Adaptado.)
FUVEST 2020 - Os chamados “remédios homeopáticos” são produzidos
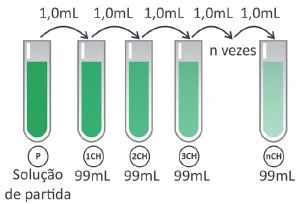
Química - 2020Os chamados “remédios homeopáticos” são produzidos seguindo a farmacotécnica homeopática, que se baseia em diluições sequenciais de determinados compostos naturais. A dosagem utilizada desses produtos é da ordem de poucos mL. Uma das técnicas de diluição homeopática é chamada de diluição centesimal (CH), ou seja, uma parte da solução é diluída em 99 partes de solvente e a solução resultante é homogeneizada (ver esquema).

As clorofilas a e b estão presentes na estrutura celular - UNESP 2020
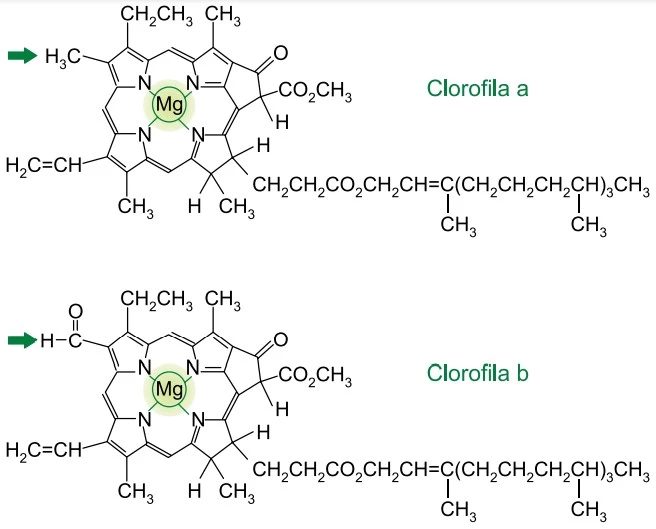
Química - 2020Analise as estruturas das clorofilas a e b.
FUVEST 2020 - O gás hélio disponível comercialmente pode ser gerado
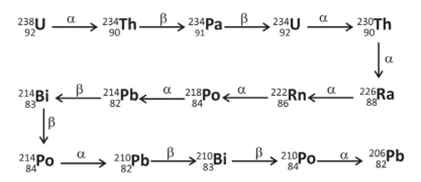
Química - 2020O gás hélio disponível comercialmente pode ser gerado pelo decaimento radioativo, sobretudo do urânio, conforme esquematizado pela série de decaimento. Desde a formação da Terra, há 4,5 bilhões de anos, apenas metade do 238U decaiu para a formação de He.
As antocianinas existem em plantas superiores e são - UNESP 2020
Química - 2020As antocianinas existem em plantas superiores e são responsáveis pelas tonalidades vermelhas e azuis das flores e frutos. Esses corantes naturais apresentam estruturas diferentes conforme o pH do meio, o que resulta em cores diferentes.
O cátion flavílio, por exemplo, é uma antocianina que apresenta cor vermelha e é estável em pH ≈ 1. Se juntarmos uma solução dessa antocianina a uma base, de modo a ter pH por volta de 5, veremos, durante a mistura, uma bonita cor azul, que não é estável e logo desaparece.
Verificou-se que a adição de base a uma solução do cátion flavílio com pH ≈ 1 dá origem a uma cinética com 3 etapas de tempos muito diferentes. A primeira etapa consiste na observação da cor azul, que ocorre durante o tempo de mistura da base. A seguir, na escala de minutos, ocorre outra reação, correspondendo ao desaparecimento da cor azul e, finalmente, uma terceira que, em horas, dá origem a pequenas variações no espectro de absorção, principalmente na zona do ultravioleta.
FUVEST 2020 - Os movimentos das moléculas antes e depois de uma reação
Química - 2020Os movimentos das moléculas antes e depois de uma reação química obedecem aos princípios físicos de colisões. Para tanto, cada átomo é representado como um corpo pontual com uma certa massa, ocupando uma posição no espaço e com uma determinada velocidade (representada na forma vetorial). Costumeiramente, os corpos pontuais são representados como esferas com diâmetros proporcionais à massa atômica. As colisões ocorrem conservando a quantidade de movimento.
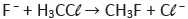
Considere um cubo de aço inoxidável cujas arestas medem - UNESP 2020
Química - 2020Considere um cubo de aço inoxidável cujas arestas medem 1 cm.
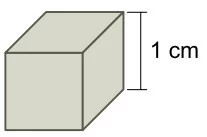
Quando o nosso corpo é lesionado por uma pancada, logo se - FUVEST
Química - 2020Quando o nosso corpo é lesionado por uma pancada, logo se cria um hematoma que, ao longo do tempo, muda de cor. Inicialmente, o hematoma torna‐se avermelhado pelo acúmulo de hemoglobina. Em seguida, surge uma coloração azulada, decorrente da perda do O2 ligado ao Fe do grupo heme. Essa coloração torna‐se, então, esverdeada (biliverdina) e, após isso, surge um tom amarelado na pele (bilirrubina). Essa sequência de cores ocorre pela transformação do grupo heme da hemoglobina, como representado a seguir:
Uma das principais razões que levam o mercúrio a ser - UNESP 2020
Química - 2020Lâmpadas sem mercúrio
Agora que os LEDs estão jogando para escanteio as lâmpadas fluorescentes compactas e seu conteúdo pouco amigável ao meio ambiente, as preocupações voltam-se para as lâmpadas ultravioletas, que também contêm o tóxico mercúrio.
Embora seja importante proteger-nos de muita exposição à radiação UV do Sol, a luz ultravioleta também tem propriedades muito úteis. Isso se aplica à luz UV com comprimentos de onda curtos, de 100 a 280 nanômetros, chamada luz UVC, que é especialmente útil por sua capacidade de destruir bactérias e vírus.
Para eliminar a necessidade do mercúrio para geração da luz UVC, Ida Hoiaas, da Universidade Norueguesa de Ciência e Tecnologia, montou um diodo pelo seguinte procedimento: inicialmente, depositou uma camada de grafeno (uma variedade cristalina do carbono) sobre uma placa de vidro. Sobre o grafeno, dispôs nanofios de um semicondutor chamado nitreto de gálio-alumínio (AlGaN). Quando o diodo é energizado, os nanofios emitem luz UV, que brilha através do grafeno e do vidro.
No nitreto de gálio-alumínio, os números de oxidação do - UNESP 2020
Química - 2020Lâmpadas sem mercúrio
Agora que os LEDs estão jogando para escanteio as lâmpadas fluorescentes compactas e seu conteúdo pouco amigável ao meio ambiente, as preocupações voltam-se para as lâmpadas ultravioletas, que também contêm o tóxico mercúrio.
Embora seja importante proteger-nos de muita exposição à radiação UV do Sol, a luz ultravioleta também tem propriedades muito úteis. Isso se aplica à luz UV com comprimentos de onda curtos, de 100 a 280 nanômetros, chamada luz UVC, que é especialmente útil por sua capacidade de destruir bactérias e vírus.
Para eliminar a necessidade do mercúrio para geração da luz UVC, Ida Hoiaas, da Universidade Norueguesa de Ciência e Tecnologia, montou um diodo pelo seguinte procedimento: inicialmente, depositou uma camada de grafeno (uma variedade cristalina do carbono) sobre uma placa de vidro. Sobre o grafeno, dispôs nanofios de um semicondutor chamado nitreto de gálio-alumínio (AlGaN). Quando o diodo é energizado, os nanofios emitem luz UV, que brilha através do grafeno e do vidro.
Nesse caso, a estrutura do composto colorido formado será -FUVEST 2020
Química - 2020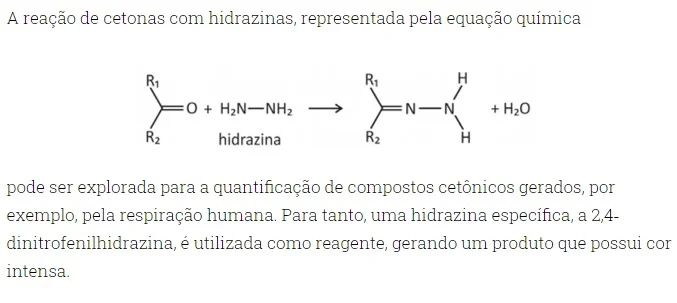
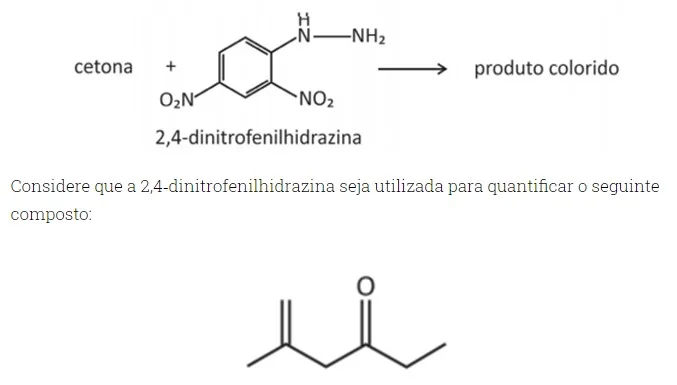
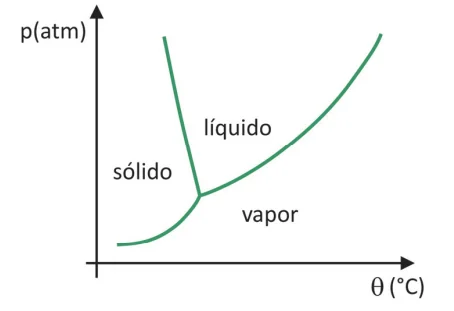
Apesar de ser um processo que requer, industrialmente - FUVEST 2020
Química - 2020Em supermercados, é comum encontrar alimentos chamados de liofilizados, como frutas, legumes e carnes. Alimentos liofilizados continuam próprios para consumo após muito tempo, mesmo sem refrigeração. O termo “liofilizado”, nesses alimentos, refere‐se ao processo de congelamento e posterior desidratação por sublimação da água. Para que a sublimação da água ocorra, é necessária uma combinação de condições, como mostra o gráfico de pressão por temperatura, em que as linhas representam transições de fases.
Para obter energia térmica, com a finalidade de fundir - UNESP 2020
Química - 2020Para obter energia térmica, com a finalidade de fundir determinada massa de gelo, produziu-se a combustão de um mol de gás butano (C4H10), a 1 atm e a 25ºC. A reação de combustão desse gás é:
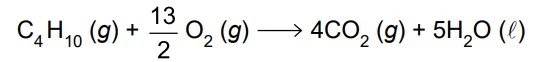
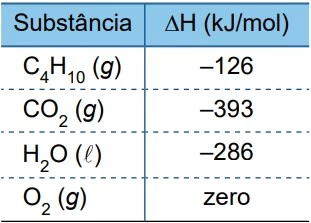
As entalpias-padrão de formação (ΔH) das substâncias citadas estão indicadas na tabela:
Em 15 de abril de 2019, a Catedral de Notre-Dame de - UNICAMP 2020
Química - 2020Em 15 de abril de 2019, a Catedral de Notre-Dame de Paris ardeu em chamas, atingindo temperaturas de 800°C. Estima-se que, na construção da catedral, foram empregadas pelo menos 300 toneladas de chumbo. Material usual à época, o chumbo é um metal pesado com elevado potencial de contaminação em altas temperaturas.
O “Ebulidor de Franklin” é um brinquedo constituído de - UNICAMP 2020
Química - 2020O “Ebulidor de Franklin” é um brinquedo constituído de dois bulbos de vidro conectados por um tubo espiralado, preenchido com líquido colorido. Seu uso consiste em encostar a mão na base do bulbo inferior, fazendo com que o líquido seja aquecido e ascenda para o bulbo superior.
Popularmente, a libido de uma pessoa é avaliada com base na quantidade de líquido que ascende. O sucesso de venda, obviamente, é maior quanto mais positivamente o brinquedo indicar uma “alta libido”. Abaixo apresenta-se um gráfico da pressão de vapor em função da temperatura para dois líquidos, A e B, que poderiam ser utilizados para preencher o “Ebulidor de Franklin”.
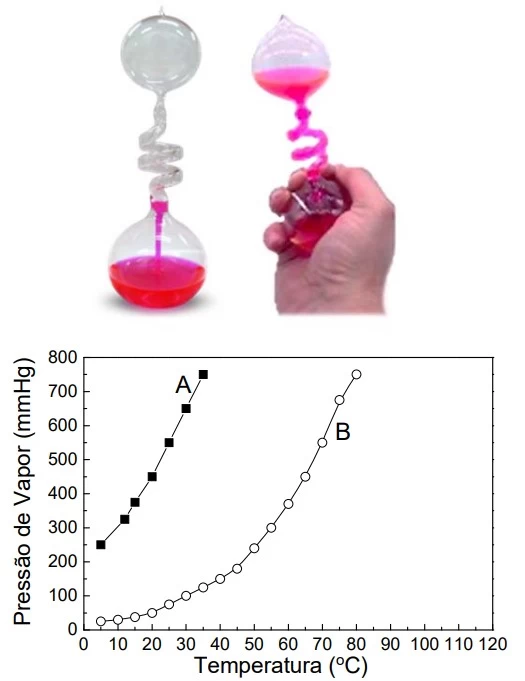
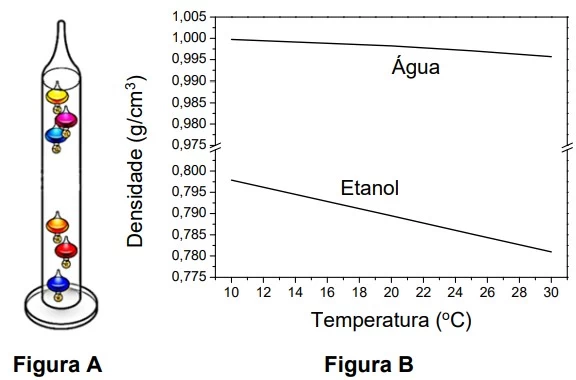
O Termômetro de Galileu (Figura A) é uma forma criativa - UNICAMP 2020
Química - 2020O Termômetro de Galileu (Figura A) é uma forma criativa de se estimar a temperatura ambiente. Ele consiste em uma coluna de vidro preenchida com um líquido. Em seu interior, são colocadas várias bolas de vidro colorido calibradas e marcadas para a leitura da temperatura. As bolas de vidro sobem ou descem em função da temperatura. A sensibilidade do Termômetro de Galileu reside na sua capacidade de separar duas leituras de temperaturas. A figura B é um gráfico de densidade em função da temperatura para água e etanol, dois líquidos que poderiam ser usados no termômetro.
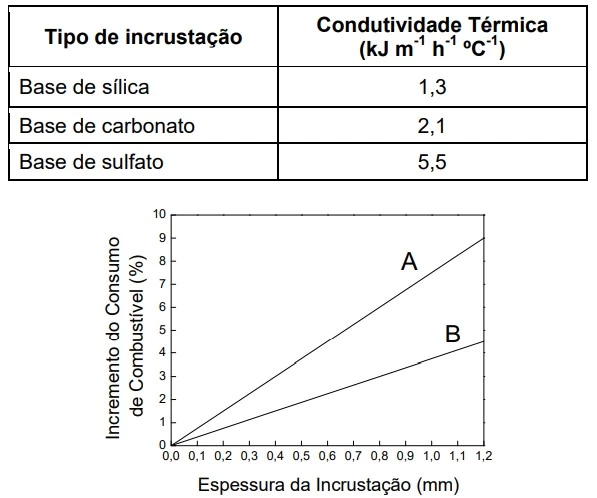
As caldeiras são utilizadas para alimentar máquinas nos - UNICAMP 2020
Química - 2020As caldeiras são utilizadas para alimentar máquinas nos mais diversos processos industriais, para esterilização de equipamentos e instrumentos em hospitais, hotéis, lavanderias, entre outros usos. A temperatura elevada da água da caldeira mantém compostos solubilizados na água de alimentação que tendem a se depositar na superfície de troca térmica da caldeira. Esses depósitos, ou incrustações, diminuem a eficiência do equipamento e, além de aumentar o consumo de combustível, podem ainda resultar em explosões. A tabela e a figura a seguir apresentam, respectivamente, informações sobre alguns tipos de incrustações em caldeiras, e a relação entre a espessura da incrustação e o consumo de combustível para uma eficiência constante.
Balões de Mylar metalizados são bastante comuns em - UNICAMP 2020
Química - 2020Balões de Mylar metalizados são bastante comuns em festas, sendo comercializados em lojas e parques.
Ascendem na atmosfera quando preenchidos com gás hélio e só murcham definitivamente se apresentarem algum vazamento. Imagine que um cliente tenha comprado um desses balões e, após sair da loja, retorna para reclamar, dizendo: “não bastasse a noite fria que está lá fora, ainda tenho que voltar para trocar o balão com defeito”.
Estudos sobre modelos atômicos foram fundamentais para o - UNESP 2020
Química - 2020Estudos sobre modelos atômicos foram fundamentais para o desenvolvimento da Química como ciência. Por volta de 450 a.C., os filósofos gregos Leucipo e Demócrito construíram a hipótese de que o mundo e, em consequência, a matéria eram constituídos a partir de unidades idênticas e indivisíveis, chamadas átomos. Contudo, foi somente a partir do século XIX que a realização de experimentos tornou possível a comprovação de hipóteses desenvolvidas ao longo do tempo. Um dos primeiros modelos aceitos foi criado por John Dalton, apresentado em um livro de sua autoria, publicado em 1808. Anos depois, outros dois principais modelos foram desenvolvidos, até que, em 1913, o físico Niels Bohr publicou um livro com sua teoria sobre o modelo atômico.
Um medicamento se apresenta na forma de comprimidos de - UNICAMP 2020
Química - 2020Um medicamento se apresenta na forma de comprimidos de 750 mg ou como suspensão oral na concentração de 100 mg/mL. A bula do remédio informa que o comprimido não pode ser partido, aberto ou mastigado e que, para crianças abaixo de 12 anos, a dosagem máxima é de 15mg/kg/dose.
A atividade humana tem grande impacto na biosfera; um - UNICAMP 2020
Química - 2020A atividade humana tem grande impacto na biosfera; um exemplo é o que vem ocorrendo na água dos oceanos nas últimas décadas. Assinale a alternativa que corretamente evidencia a influência da atividade humana no pH da água dos oceanos e como ela se acentua em função da região do planeta.
Apoie nosso trabalho!
Assine Agora