Química
Exibindo questões de 401 a 500.
Uma equação química é uma equação matemática no sentido - UNICAMP 2017
Química - 2017Uma equação química é uma equação matemática no sentido de representar uma igualdade: todos os átomos e suas quantidades que aparecem nos reagentes também devem constar nos produtos. Considerando uma equação química e sua correspondente constante de equilíbrio, pode-se afirmar corretamente que, multiplicando-se todos os seus coeficientes por 2, a constante de equilíbrio associada a esta nova equação será
Ironia ao natural É natural, é bom e quanto mais melhor - UNICAMP 2017
Química - 2017Ironia ao natural
É natural,
é bom
e quanto mais melhor,
como os cogumelos
vermelhos,
as rãs azuis
ou o suco de serpente...
É químico,
processado,
é mau,
como a
aspirina,
um perfume
ou o plástico
da válvula
cardíaca
de um coração...
Para obtermos 100 mL de uma solução aquosa saturada de - FATEC 2016
Química - 2016Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução
saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel. A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
A fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
Um aluno da Fatec foi ao laboratório de Química para - FATEC 2016
Química - 2016Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução
saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel. A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
A fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
As soluções de NaOH ou Ca(OH)2, apresentam soluto de - FATEC 2016
Química - 2016Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução
saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel. A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
A fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
A fenolftaleína atua como um indicador ácido-base por ser - FATEC 2016
Química - 2016Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução
saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel. A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
A fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
Observe a estrutura da fenolftaleína. Além da função - FATEC 2016
Química - 2016Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução
saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel. A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
A fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
A partir das informações contidas no texto, é correto - UNESP 2016
Química - 2016Leia o texto e examine a tabela para responder às questões 69 e 70.
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungestênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de 3 000°C.
Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.
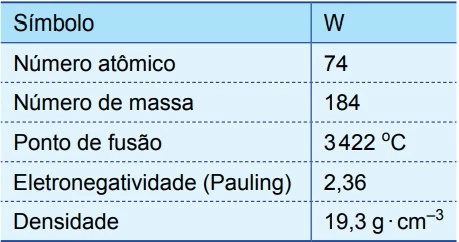
A partir das informações contidas na tabela, é correto - UNESP 2016
Química - 2016Leia o texto e examine a tabela para responder às questões 69 e 70.
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungestênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de 3 000°C.
Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.

Em 1913, Niels Bohr (1885-1962) propôs um modelo que - UNESP 2016
Química - 2016Leia o texto para responder às questões 71 e 72.
A luz branca é composta por ondas eletromagnéticas de todas as frequências do espectro visível. O espectro de radiação emitido por um elemento, quando submetido a um arco elétrico ou a altas temperaturas, é descontínuo e apresenta uma de suas linhas com maior intensidade, o que fornece “uma impressão digital” desse elemento. Quando essas linhas estão situadas na região da radiação visível, é possível identificar diferentes elementos químicos por meio dos chamados testes de chama. A tabela apresenta as cores características emitidas por alguns elementos no teste de chama:
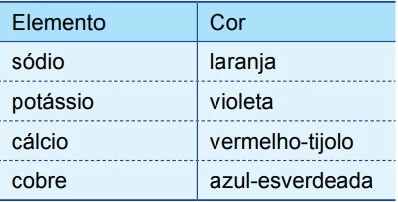
Uma estudante preparou 10,0 mL de uma solução 1,00 mol - UNESP 2016
Química - 2016Leia o texto para responder às questões 71 e 72.
A luz branca é composta por ondas eletromagnéticas de todas as frequências do espectro visível. O espectro de radiação emitido por um elemento, quando submetido a um arco elétrico ou a altas temperaturas, é descontínuo e apresenta uma de suas linhas com maior intensidade, o que fornece “uma impressão digital” desse elemento. Quando essas linhas estão situadas na região da radiação visível, é possível identificar diferentes elementos químicos por meio dos chamados testes de chama. A tabela apresenta as cores características emitidas por alguns elementos no teste de chama:

A partir das informações contidas no texto, é - UNESP 2016
Química - 2016Leia o texto para responder às questões de 73 a 75.
A bioluminescência é o fenômeno de emissão de luz visível por certos organismos vivos, resultante de uma reação química entre uma substância sintetizada pelo próprio organismo (luciferina) e oxigênio molecular, na presença de uma enzima (luciferase). Como resultado dessa reação bioquímica é gerado um produto em um estado eletronicamente excitado (oxiluciferina*). Este produto, por sua vez, desativa-se por meio da emissão de luz visível, formando o produto no estado normal ou fundamental (oxiluciferina). Ao final, a concentração de luciferase permanece constante.

O esquema ilustra o mecanismo geral da reação de bioluminescência de vagalumes, no qual são formados dois produtos diferentes em estados eletronicamente excitados, responsáveis pela emissão de luz na cor verde ou na cor vermelha.
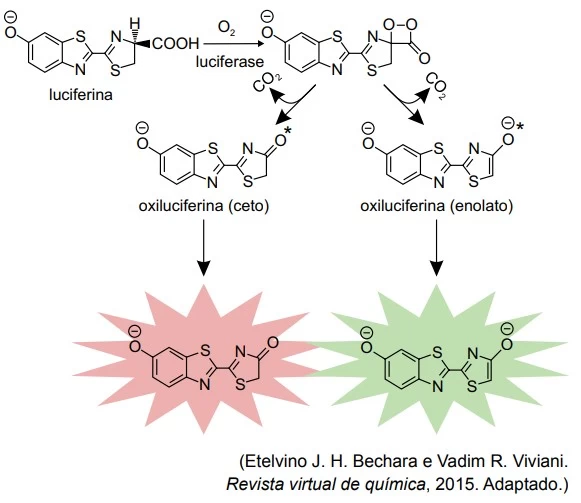
Com base nas informações apresentadas no texto e - UNESP 2016
Química - 2016Leia o texto para responder às questões de 73 a 75.
A bioluminescência é o fenômeno de emissão de luz visível por certos organismos vivos, resultante de uma reação química entre uma substância sintetizada pelo próprio organismo (luciferina) e oxigênio molecular, na presença de uma enzima (luciferase). Como resultado dessa reação bioquímica é gerado um produto em um estado eletronicamente excitado (oxiluciferina*). Este produto, por sua vez, desativa-se por meio da emissão de luz visível, formando o produto no estado normal ou fundamental (oxiluciferina). Ao final, a concentração de luciferase permanece constante.

O esquema ilustra o mecanismo geral da reação de bioluminescência de vagalumes, no qual são formados dois produtos diferentes em estados eletronicamente excitados, responsáveis pela emissão de luz na cor verde ou na cor vermelha.

De acordo com o texto e utilizando a classificação - UNESP 2016
Química - 2016Leia o texto para responder às questões de 73 a 75.
A bioluminescência é o fenômeno de emissão de luz visível por certos organismos vivos, resultante de uma reação química entre uma substância sintetizada pelo próprio organismo (luciferina) e oxigênio molecular, na presença de uma enzima (luciferase). Como resultado dessa reação bioquímica é gerado um produto em um estado eletronicamente excitado (oxiluciferina*). Este produto, por sua vez, desativa-se por meio da emissão de luz visível, formando o produto no estado normal ou fundamental (oxiluciferina). Ao final, a concentração de luciferase permanece constante.

O esquema ilustra o mecanismo geral da reação de bioluminescência de vagalumes, no qual são formados dois produtos diferentes em estados eletronicamente excitados, responsáveis pela emissão de luz na cor verde ou na cor vermelha.

Com a crescente crise mundial de dengue, as pesquisas - UNICAMP 2016
Química - 2016Com a crescente crise mundial de dengue, as pesquisas pela busca tanto de vacinas quanto de repelentes de insetos têm se intensificado. Nesse contexto, os compostos I e II abaixo representados têm propriedades muito distintas: enquanto um deles tem caráter ácido e atrai os insetos, o outro tem caráter básico e não os atrai.
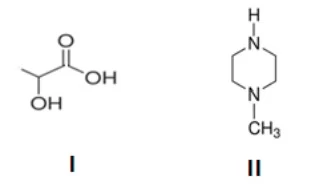
Em seu livro Como se faz Química, o Professor Aécio - UNICAMP 2016
Química - 2016Em seu livro Como se faz Química, o Professor Aécio Chagas afirma que “quem transforma a matéria, sem pensar sobre ela, não é, e jamais será um químico”.
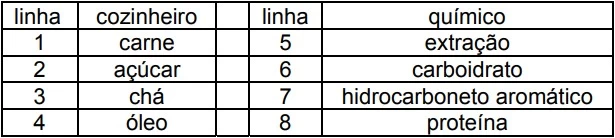
Considere alguns produtos que um cozinheiro reconhece nas linhas 1-4 do quadro a seguir, e aqueles que um químico reconhece nas linhas 5-8.
O trecho seguinte foi extraído de uma revista de - UNICAMP 2016
Química - 2016O trecho seguinte foi extraído de uma revista de divulgação do conhecimento químico, e trata de alguns aspectos da lavagem a seco de tecidos. “Tratando-se do desempenho para lavar, o tetracloroetileno é um solvente efetivo para limpeza das roupas, pois evita o encolhimento dos tecidos, já que evapora facilmente, dada sua baixa pressão de vapor (0,017 atm., 20°C), e dissolve manchas lipofílicas, como óleos, ceras e gorduras em geral...” A leitura desse trecho sugere que o tetracloroetileno é um líquido apolar e sua alta volatilidade se deve ao seu baixo valor de pressão de vapor.
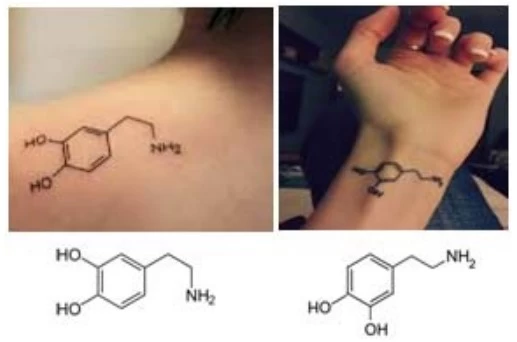
Atualmente, parece que a Química vem seduzindo as - UNICAMP 2016
Química - 2016Atualmente, parece que a Química vem seduzindo as pessoas e tem-se observado um número cada vez maior de pessoas portando tatuagens que remetem ao conhecimento químico. As figuras a seguir mostram duas tatuagens muito parecidas, com as correspondentes imagens tatuadas mais bem definidas abaixo.
A preocupação com a emissão de gases poluentes no meio -UNICAMP 2016
Química - 2016A preocupação com a emissão de gases poluentes no meio ambiente está muito presente na indústria automobilística. Recentemente, uma das soluções encontradas para contornar esse problema nos veículos movidos a Diesel foi o desenvolvimento do Arla 32, uma solução de ureia em água, que atua nos sistemas de exaustão, de acordo com as equações químicas abaixo:
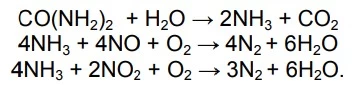
Podemos obter energia no organismo pela oxidação de - UNICAMP 2016
Química - 2016Podemos obter energia no organismo pela oxidação de diferentes fontes. Entre essas fontes destacam-se a gordura e o açúcar. A gordura pode ser representada por uma fórmula mínima (CH2)n enquanto um açúcar pode ser representado por (CH2O)n.
Alguns trabalhos científicos correlacionam as mudanças - UNICAMP 2016
Química - 2016Alguns trabalhos científicos correlacionam as mudanças nas concentrações dos sais dissolvidos na água do mar com as mudanças climáticas. Entre os fatores que poderiam alterar a concentração de sais na água do mar podemos citar: evaporação e congelamento da água do mar, chuva e neve, além do derretimento das geleiras.
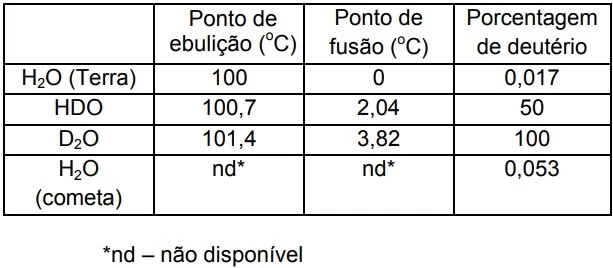
A comparação entre as proporções isotópicas de amostras - UNICAMP 2016
Química - 2016A comparação entre as proporções isotópicas de amostras de um mesmo material, que têm a mesma idade, encontradas em diferentes regiões, pode ser utilizada para revelar se elas têm ou não a mesma origem. Se as proporções são iguais, então é possível que tenham a mesma origem, mas se forem diferentes, é certeza que não têm a mesma origem. A tabela a seguir apresenta os dados de algumas amostras de água, incluindo a de um cometa no qual uma sonda pousou recentemente.
As empresas que fabricam produtos de limpeza têm se - UNICAMP 2016
Química - 2016As empresas que fabricam produtos de limpeza têm se preocupado cada vez mais com a satisfação do consumidor e a preservação dos materiais que estão sujeitos ao processo de limpeza. No caso do vestuário, é muito comum encontrarmos a recomendação para fazer o teste da firmeza das cores para garantir que a roupa não será danificada no processo de lavagem. Esse teste consiste em molhar uma pequena parte da roupa e colocá-la sobre uma superfície plana; em seguida, coloca-se um pano branco de algodão sobre sua superfície e passa-se com um ferro bem quente.
Os compostos (NH4)H2PO4 e NaHCO3 são usados em extintor - UNICAMP 2016
Química - 2016Os compostos (NH4)H2PO4 e NaHCO3 são usados em extintores como agentes de combate ao fogo. Quando lançados sobre uma chama, ocorrem as seguintes transformações:
(NH4)H2PO4 → NH3 + H3PO4
H3PO4 → polifosfato (viscoso)
NaHCO3 → CO2 + H2O + Na2CO3 (particulado).
No combate a todos os tipos de incêndio, a nuvem formada de gás é importante, mas naqueles envolvendo materiais sólidos, o depósito do material oriundo da transformação do agente de combate sobre o combustível tem papel decisivo. Assim, o agente (NH4)H2PO4 pode substituir o NaHCO3 em qualquer situação, mas o contrário não é verdade.
A tira tematiza a contribuição da atividade humana para - UNICAMP 2016
Química - 2016A tira tematiza a contribuição da atividade humana para a deterioração do meio ambiente. Do diálogo apresentado, pode-se depreender que os ursos já sabiam

Em seus trabalhos, uma serralheria gera raspas de ferro - FAMERP 2016
Química - 2016Em seus trabalhos, uma serralheria gera raspas de ferro, de cobre e de alumínio, que ficam misturadas em um único recipiente.
A imagem mostra cilindros de mesma capacidade, cada um - FAMERP 2016
Química - 2016A imagem mostra cilindros de mesma capacidade, cada um com gás de uma substância diferente, conforme indicado, todos à mesma pressão e temperatura.
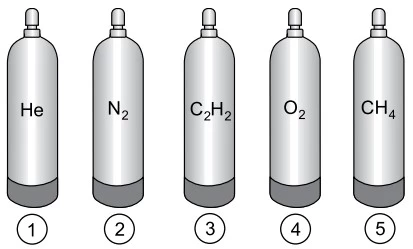
A massa de sulfato de amônio, em gramas, que contém a - FAMERP 2016
Química - 2016Leia o texto para responder às questões 53 e 54.
Ureia, CO (NH2)2, e sulfato de amônio, (NH4)2SO4, são substâncias amplamente empregadas como fertilizantes nitrogenados.
Comparando-se as duas substâncias quanto às ligações - FAMERP 2016
Química - 2016Leia o texto para responder às questões 53 e 54.
Ureia, CO (NH2)2, e sulfato de amônio, (NH4)2SO4, são substâncias amplamente empregadas como fertilizantes nitrogenados.
A água boricada é uma solução aquosa de ácido bórico - FAMERP 2016
Química - 2016A água boricada é uma solução aquosa de ácido bórico, H3BO3, a 3% (m/V).
A molécula da liotironina apresenta a) átomo de carbono - FAMERP 2016
Química - 2016As questões de 56 a 58 referem-se à liotironina, um hormônio produzido pela glândula tireoide, também conhecido como T3.
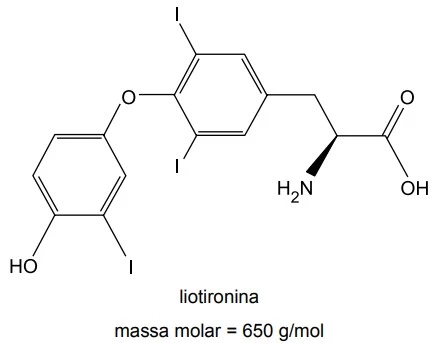
Dentre as funções orgânicas presentes na molécula de - FAMERP 2016
Química - 2016As questões de 56 a 58 referem-se à liotironina, um hormônio produzido pela glândula tireoide, também conhecido como T3.

Considerando que a constante de Avogadro vale - FAMERP 2016
Química - 2016As questões de 56 a 58 referem-se à liotironina, um hormônio produzido pela glândula tireoide, também conhecido como T3.

A imagem mostra o resultado de um experimento conhecido - FAMERP 2016
Química - 2016A imagem mostra o resultado de um experimento conhecido como “árvore de prata”, em que fios de cobre retorcidos em formato de árvore são imersos em uma solução aquosa de nitrato de prata.

Considere o equilíbrio químico representado por - FAMERP 2016
Química - 2016Considere o equilíbrio químico representado por
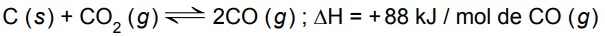
Uma estudante recebeu uma amostra de ácido benzoico - FUVEST 2016
Química - 2016Uma estudante recebeu uma amostra de ácido benzoico sólido contendo impurezas. Para purificá-lo, ela optou por efetuar uma recristalização. No procedimento adotado, o sólido deve ser dissolvido em um solvente aquecido, e a solução assim obtida deve ser resfriada. Sendo as impurezas mais solúveis à temperatura ambiente, ao final devem ser obtidos cristais de ácido benzoico puro.
Para escolher o solvente apropriado para essa purificação, a estudante fez testes de solubilidade com etanol, água e heptano. Inicialmente, os testes foram efetuados à temperatura ambiente, e a estudante descartou o uso de etanol. A seguir, efetuou testes a quente, e o heptano não se mostrou adequado.
Nos testes de solubilidade, a estudante observou a formação de sistema heterogêneo quando tentou dissolver o ácido benzoico impuro em
O biogás pode substituir a gasolina na geração de - FUVEST 2016
Química - 2016O biogás pode substituir a gasolina na geração de energia. Sabe-se que 60%, em volume, do biogás são constituídos de metano, cuja combustão completa libera cerca de 900 kJ/moL.
Uma usina produtora gera 2.000 litros de biogás por dia. Para produzir a mesma quantidade de energia liberada pela queima de todo o metano contido nesse volume de biogás, será necessária a seguinte quantidade aproximada (em litros) de gasolina:
Um aldeído pode ser transformado em um aminoácido pela - FUVEST 2016
Química - 2016Um aldeído pode ser transformado em um aminoácido pela sequência de reações:

O aminoácido N-metil-fenilalanina pode ser obtido pela mesma sequência reacional, empregando-se, em lugar do cloreto de amônio (NH4Cl), o reagente CH3NH3Cl.
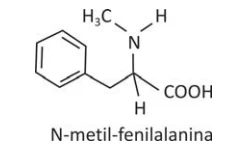
Para que um planeta abrigue vida nas formas que - FUVEST 2016
Química - 2016Para que um planeta abrigue vida nas formas que conhecemos, ele deve apresentar gravidade adequada, campo magnético e água no estado líquido. Além dos elementos químicos presentes na água, outros também são necessários. A detecção de certas substâncias em um planeta pode indicar a presença dos elementos químicos necessários à vida. Observações astronômicas de cinco planetas de fora do sistema solar indicaram, neles, a presença de diferentes substâncias, conforme o quadro a seguir:

Um dirigível experimental usa hélio como fluido - FUVEST 2016
Química - 2016Um dirigível experimental usa hélio como fluido ascensional e octano (C8H18) como combustível em seu motor, para propulsão. Suponha que, no motor, ocorra a combustão completa do octano:
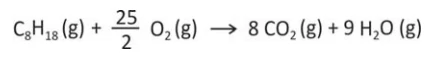
Para compensar a perda de massa do dirigível à medida que o combustível é queimado, parte da água contida nos gases de exaustão do motor é condensada e armazenada como lastro. O restante do vapor de água e o gás carbônico são liberados para a atmosfera.
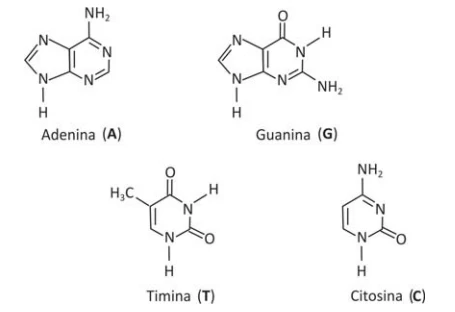
A estrutura do DNA é formada por duas cadeias contendo - FUVEST 2016
Química - 2016A estrutura do DNA é formada por duas cadeias contendo açúcares e fosfatos, as quais se ligam por meio das chamadas bases nitrogenadas, formando a dupla hélice. As bases timina, adenina, citosina e guanina, que formam o DNA, interagem por ligações de hidrogênio, duas a duas em uma ordem determinada. Assim, a timina, de uma das cadeias, interage com a adenina, presente na outra cadeia, e a citosina, de uma cadeia, interage com a guanina da outra cadeia.
Considere as seguintes bases nitrogenadas:
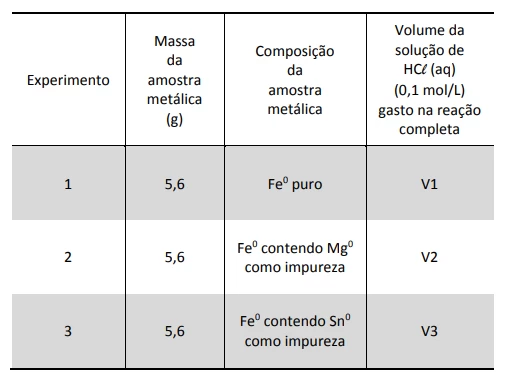
Sabe-se que os metais ferro (Fe0), magnésio (Mg0) e - FUVEST 2016
Química - 2016Sabe-se que os metais ferro (Fe0), magnésio (Mg0) e estanho (Sn0) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
Foram feitos três experimentos em que três amostras metálicas de mesma massa reagiram, separada e completamente, com uma solução aquosa de ácido clorídrico (HCl (aq)) de concentração 0,1 mol/L. Os resultados obtidos foram:
Fenol e metanal (aldeído fórmico), em presença de um - FUVEST 2016
Química - 2016Fenol e metanal (aldeído fórmico), em presença de um catalisador, reagem formando um polímero que apresenta alta resistência térmica. No início desse processo, pode-se formar um composto com um grupo — CH2OH ligado no carbono 2 ou no carbono 4 do anel aromático. O esquema a seguir apresenta as duas etapas iniciais do processo de polimerização para a reação no carbono 2 do fenol.
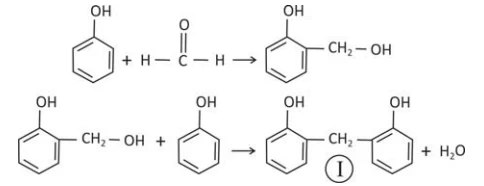
Considere que, na próxima etapa desse processo de polimerização, a reação com o metanal ocorra no átomo de carbono 4 de um dos anéis de (I). Assim, no esquema
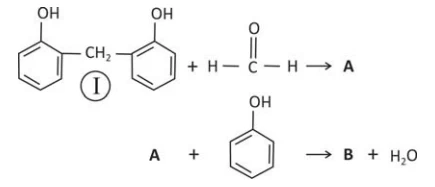
A e B podem ser, respectivamente,
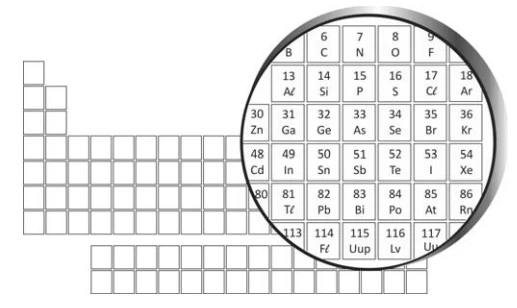
O fleróvio (Fl) é um elemento químico artificial, de - FUVEST 2016
Química - 2016O fleróvio (Fl) é um elemento químico artificial, de número atômico 114. Na tabela periódica, está situado imediatamente abaixo do elemento de número atômico 82, que é o chumbo (Pb), como é mostrado na figura a seguir:
Até o momento, só foi possível sintetizar poucos átomos de fleróvio na forma dos isótopos 288 e 289, pela fusão dos elementos plutônio e cálcio em um acelerador de partículas. Para o fleróvio-289, o processo de síntese pode ser representado pela equação nuclear a seguir:
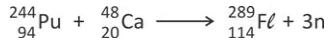
Considere as seguintes afirmações;
I. A aparência macroscópica do fleróvio é desconhecida, mas, provavelmente, será a de um sólido metálico.
II. Na formação do fleróvio-288, por processo análogo ao da síntese do fleróvio-289, são liberados 3 prótons.
III. No grupo da tabela periódica ao qual pertence o fleróvio, há elementos que formam óxidos covalentes.
Na tabela, são apresentadas informações dos rótulos de dois - FGV 2016
Química - 2016Na tabela, são apresentadas informações dos rótulos de dois produtos comercializados por uma indústria alimentícia.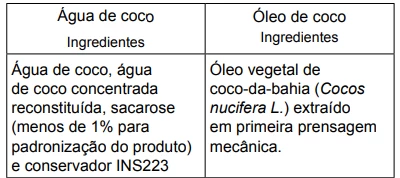
Para melhorar as qualidades nutricionais desses produtos, o fabricante pretende adicionar a cada um deles vitaminas solúveis, tendo como opção aquelas representadas na figura.
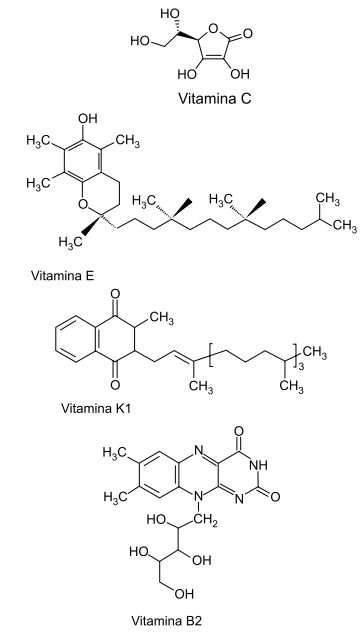
Um novo tipo de material especial, seleneto de bismuto, - FGV 2016
Química - 2016Um novo tipo de material especial, seleneto de bismuto, capaz de conduzir eletricidade em sua superfície, não em seu interior, quando em contato com um semicondutor, arseneto de gálio, resulta em um material que conduz eletricidade em várias direções e com níveis de energia diferentes. Esses compostos seguem a fórmula XyYx e suas ligações podem ser consideradas iônicas. Os íons negativos seguem a regra do octeto, enquanto que os íons positivos apresentam a mesma carga que o íon alumínio.
O nitrito de sódio, NaNO2 , é um conservante de alimentos - FGV 2016
Química - 2016O nitrito de sódio, NaNO2 , é um conservante de alimentos processados a partir de carnes e peixes. Os dados de solubilidade deste sal em água são apresentados na tabela.

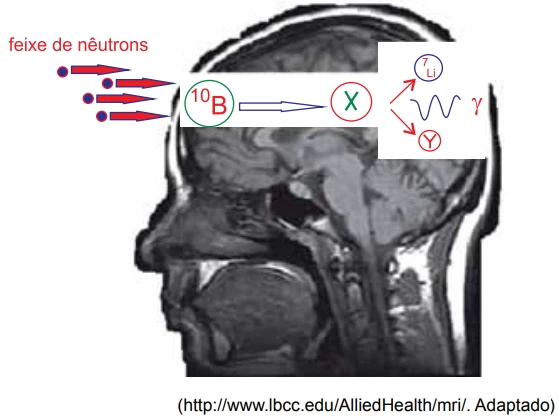
A medicina tem desenvolvido diversos tratamentos para - FGV 2016
Química - 2016A medicina tem desenvolvido diversos tratamentos para pacientes com câncer de cérebro. Em um deles, o paciente ingere o composto borofenilalanina. Essa molécula que contém o isótopo boro-10 tem afinidade pelas células cerebrais. Após a ingestão, o paciente é submetido a um feixe de nêutrons. Cada isótopo de boro-10 captura um nêutron e forma um isótopo instável que se fissiona em duas espécies menores e emite ainda radiação gama. Dessa maneira, a célula tumoral é atingida pela energia das emissões do processo de fissão e é destruída.
(www.nipe.unicamp.br/enumas/admin/resources/uploads/robertovicente_ hasolucao.pdf. Adaptado)
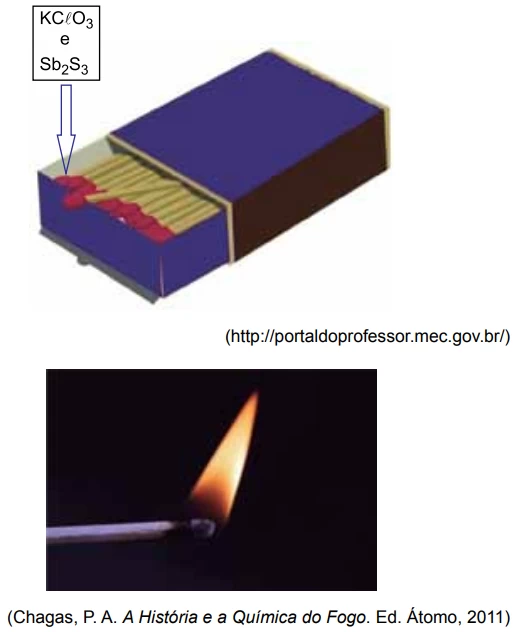
Os palitos de fósforo são dispositivos simples empregados - FGV 2016
Química - 2016Os palitos de fósforo são dispositivos simples empregados para fazer fogo. A chama se produz por meio de reações que ocorrem com as substâncias da “cabeça” do palito. Quando o palito é esfregado na superfície áspera da lateral da caixa, as substâncias reagem formando Sb2 O5 , KCl e SO2 . Essa reação é muito exotérmica e rápida e promove a reação de combustão e a propagação da chama pela madeira do palito.
Os valores dos números de oxidação do átomo de nitrogênio - FGV 2016
Química - 2016O texto seguinte refere-se à questão:
O ácido nítrico é um importante insumo para produção de fertilizantes, explosivos e tintas. Sua produção industrial é feita pelo processo Ostwald, em três etapas que podem ser representadas pelas reações:
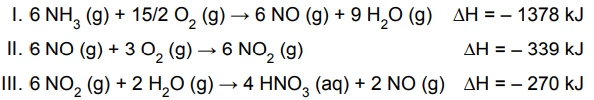
No processo Ostwald, a produção de 2,00 x 106 mol de HNO3 - FGV 2016
Química - 2016O texto seguinte refere-se à questão:
O ácido nítrico é um importante insumo para produção de fertilizantes, explosivos e tintas. Sua produção industrial é feita pelo processo Ostwald, em três etapas que podem ser representadas pelas reações:
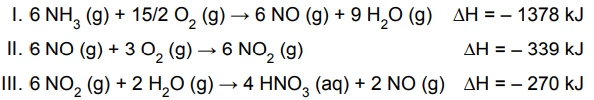
Em um experimento em laboratório de química, montou-se uma - FVG 2016
Química - 2016Em um experimento em laboratório de química, montou-se uma célula eletrolítica de acordo com o esquema:
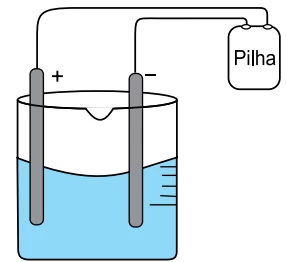
Usaram-se como eletrodo dois bastões de grafite, uma solução aquosa 1,0 mol.L–1 de CuSO4 em meio ácido a 20 o C e uma pilha.
Alguns minutos, após iniciado o experimento, observaram-se a formação de um sólido de coloração amarronzada sobre a superfície do eletrodo de polo negativo e a formação de bolhas na superfície do eletrodo de polo positivo.
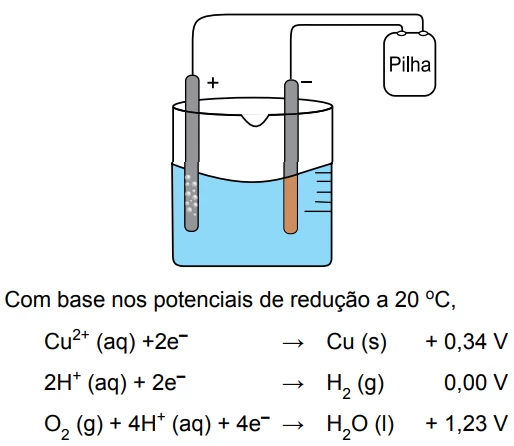
Uma indústria gera por mês 103 m3 de efluentes contendo - FGV 2016
Química - 2016O texto seguinte refere-se à questão:
O fenol é um composto químico altamente tóxico encontrado em efluentes (resíduos aquosos de processos químicos) de variadas indústrias como a farmacêutica, de tintas e de papel e celulose.
O fenol se ioniza em água de acordo com o equilíbrio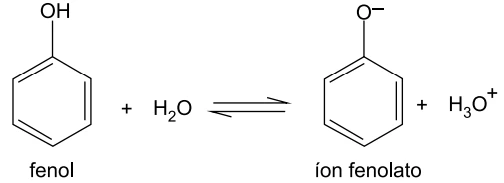
A concentração máxima permitida para fenóis em águas não cloradas é de 0,1 mg/L. Contudo, em águas cloradas, a concentração máxima permitida para fenóis pela resolução n.o 357 do CONAMA é de 0,003 mg/L.
Os químicos do laboratório de análises de uma indústria de - FGV 2016
Química - 2016O texto seguinte refere-se à questão:
O fenol é um composto químico altamente tóxico encontrado em efluentes (resíduos aquosos de processos químicos) de variadas indústrias como a farmacêutica, de tintas e de papel e celulose.
O fenol se ioniza em água de acordo com o equilíbrio
A concentração máxima permitida para fenóis em águas não cloradas é de 0,1 mg/L. Contudo, em águas cloradas, a concentração máxima permitida para fenóis pela resolução n.o 357 do CONAMA é de 0,003 mg/L.
O hidrogênio para células a combustível de uso automotivo - FGV 2016
Química - 2016O hidrogênio para células a combustível de uso automotivo poderá ser obtido futuramente a partir da reação de reforma do etanol. Atualmente, nessa reação, são gerados subprodutos indesejados: etanal (I) e etanoato de etila (II). Porém, pesquisadores da UNESP de Araraquara verificaram que, com o uso de um catalisador adequado, a produção de hidrogênio do etanol poderá ser viabilizada sem subprodutos.
Um certo polímero é produzido a partir de um monômero, que - FGV 2016
Química - 2016Um certo polímero é produzido a partir de um monômero, que é um hidrocarboneto que contém somente uma instauração. A análise elementar por combustão completa de 0,5 mol de moléculas desse hidrocarboneto resultou em 1,5 mol de moléculas de CO2 .
Os polímeros biodegradáveis podem ser empregados na - FGV 2016
Química - 2016Os polímeros biodegradáveis podem ser empregados na confecção de sacolas plásticas utilizadas nos supermercados. Esses polímeros apresentam estruturas de cadeias alifáticas com grupos funcionais hidrolisáveis.
O coque é um dos produtos da transformação do carvão - FGV 2016
Química - 2016O coque é um dos produtos da transformação do carvão mineral e é empregado para obtenção de metais em indústrias siderúrgicas. A coqueria é a unidade de processo onde o carvão mineral é aquecido na ausência de oxigênio. Esse processo se denomina __________. Nele, são separados componentes mais voláteis, e o resíduo sólido final tem __________ teor percentual de carbono do que o carvão mineral. O coque é adicionado ao alto forno no processo de redução do minério para produção de __________.
A equação química que representa a reação que ocorre - FATEC 2016/2
Química - 2016“Houston, we have a problem”. Ao enviar essa mensagem, em 13 de abril de 1970, o comandante da missão espacial Apollo 13 sabia que sua vida e as dos dois companheiros estavam por um fio. Um dos tanques de oxigênio (Os2) tinha acabado de explodir. Apesar do perigo iminente dos astronautas ficarem sem O2 para respirar, a principal preocupação da NASA era evitar que a atmosfera da espaçonave ficasse saturada do gás carbônico (CO2), exalado pela própria equipe. Isso causaria diminuição do pH do sangue da tripulação (acidemia sanguínea), já que o CO2 é um óxido ácido e, em água, ele forma ácido carbônico:
CO2 (g) + H2O (l) → H2CO3 (aq).
A acidemia sanguínea deve ser evitada a qualquer custo. Inicialmente, ela leva a pessoa a ficar desorientada e a desmaiar, podendo evoluir até o coma ou mesmo a morte. Normalmente, a presença de CO2 na atmosfera da nave não é problema, pois existem recipientes, adaptados a ventilação com hidróxido de lítio (LiOH), uma base capaz de absorver esse gás. Nada quimicamente mais sensato: remover um óxido ácido lançando mão de uma base, através de uma reação de neutralização.
O óxido que pode levar a acidemia sanguínea apresenta - FATEC 2016/2
Química - 2016“Houston, we have a problem”. Ao enviar essa mensagem, em 13 de abril de 1970, o comandante da missão espacial Apollo 13 sabia que sua vida e as dos dois companheiros estavam por um fio. Um dos tanques de oxigênio (Os2) tinha acabado de explodir. Apesar do perigo iminente dos astronautas ficarem sem O2 para respirar, a principal preocupação da NASA era evitar que a atmosfera da espaçonave ficasse saturada do gás carbônico (CO2), exalado pela própria equipe. Isso causaria diminuição do pH do sangue da tripulação (acidemia sanguínea), já que o CO2 é um óxido ácido e, em água, ele forma ácido carbônico:
CO2 (g) + H2O (l) → H2CO3 (aq).
A acidemia sanguínea deve ser evitada a qualquer custo. Inicialmente, ela leva a pessoa a ficar desorientada e a desmaiar, podendo evoluir até o coma ou mesmo a morte. Normalmente, a presença de CO2 na atmosfera da nave não é problema, pois existem recipientes, adaptados a ventilação com hidróxido de lítio (LiOH), uma base capaz de absorver esse gás. Nada quimicamente mais sensato: remover um óxido ácido lançando mão de uma base, através de uma reação de neutralização.
A reação de esterificação é uma reação reversível; - FATEC 2016/2
Química - 2016Ésteres são usados em indústrias de alimentos porque podem atribuir diferentes sabores e aromas aos produtos artificiais. São compostos orgânicos produzidos por meio das reações entre ácidos carboxílicos e álcoois, denominadas reações de esterificação.
Por exemplo, na obtenção da essência que confere o sabor de maçã verde às balas e gomas de mascar, reagimos o ácido etanoico com butan-1-ol:
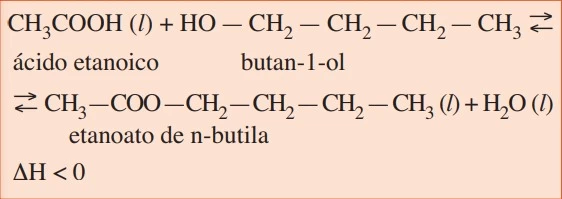
Em reação semelhante à descrita no texto, podemos obter - FATEC 2016/2
Química - 2016Ésteres são usados em indústrias de alimentos porque podem atribuir diferentes sabores e aromas aos produtos artificiais. São compostos orgânicos produzidos por meio das reações entre ácidos carboxílicos e álcoois, denominadas reações de esterificação.
Por exemplo, na obtenção da essência que confere o sabor de maçã verde às balas e gomas de mascar, reagimos o ácido etanoico com butan-1-ol:

O éster acetato de etila é utilizado na indústria - FATEC 2016/2
Química - 2016O éster acetato de etila é utilizado na indústria química como solvente e como flavorizante, para conferir sabor artificial de maçã ou pera aos alimentos.
Este composto também pode ser preparado a partir de uma reação de esterificação:

Para calcularmos a variação de entalpia da reação, ΔH, podemos aplicar a lei de Hess às equações de combustão dos compostos orgânicos presentes na reação de esterificação, apresentadas a seguir.
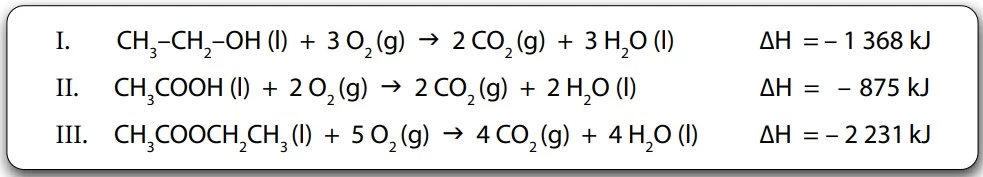
Considere amostras de 1 g de cada uma das seguintes - UNESP 2016/2
Química - 2016Considere amostras de 1 g de cada uma das seguintes substâncias: eteno (C2H4), monóxido de carbono (CO) e nitrogênio (N2). Essas três amostras
Uma forma de se obter oxigênio em laboratório é pela - UNESP 2016/2
Química - 2016Uma forma de se obter oxigênio em laboratório é pela reação química entre solução aquosa de peróxido de hidrogênio (água oxigenada) e solução aquosa de permanganato de potássio em meio ácido, cuja equação, parcialmente balanceada, é:

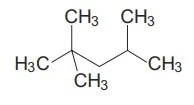
Analise a fórmula que representa a estrutura do - UNESP 2016/2
Química - 2016Analise a fórmula que representa a estrutura do isooctano, um derivado de petróleo componente da gasolina.
Considere uma pulseira formada por 22 esferas de - UNESP 2016/2
Química - 2016Considere uma pulseira formada por 22 esferas de hematita (Fe2O3), cada esfera com raio igual a 0,5 cm.

A imagem mostra o primeiro avião do mundo movido - UNESP 2016/2
Química - 2016A imagem mostra o primeiro avião do mundo movido a etanol (C2H5OH), o avião agrícola Ipanema, de fabricação brasileira.

Os gráficos ilustram a atividade catalítica de enzimas - UNESP 2016/2
Química - 2016Os gráficos ilustram a atividade catalítica de enzimas em função da temperatura e do pH.
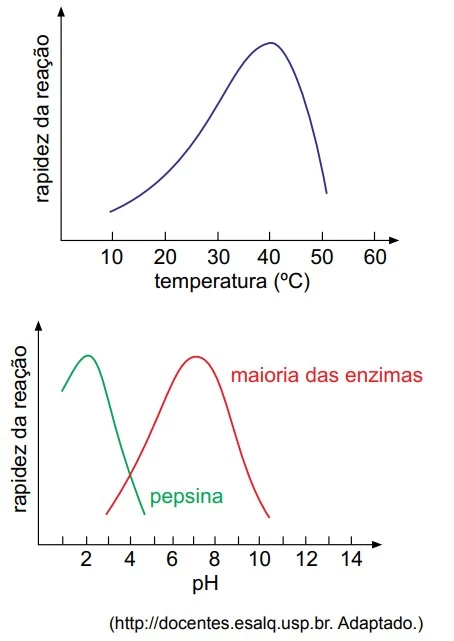
Nessa transformação do dióxido de enxofre em sulfatos - UNESP 2016/2
Química - 2016
Nas últimas décadas, o dióxido de enxofre (SO2) tem sido o principal contaminante atmosférico que afeta a distribuição de liquens em áreas urbanas e industriais. Os liquens absorvem o dióxido de enxofre e, havendo repetidas exposições a esse poluente, eles acumulam altos níveis de sulfatos (SO4 2–) e bissulfatos (HSO4–), o que incapacita os constituintes dos liquens de realizarem funções vitais, como fotossíntese, respiração e, em alguns casos, fixação de nitrogênio.
O segmento empresarial de lavanderias no Brasil tem tido um - FGV 2015
Química - 2015O segmento empresarial de lavanderias no Brasil tem tido um grande crescimento nas últimas décadas. Dentre os solventes mais empregados nas lavanderias industriais, destacam-se as isoparafinas, I, e o tetracloroetileno, II, conhecido comercialmente como percloro. Um produto amplamente empregado no setor de lavanderia hospitalar é representado na estrutura III.
(http://www.freedom.inf.br/revista/hc18/household.asp http://www.ccih.med.br/Caderno%20E.pdf. Adaptado)

O espinélio de magnésio e alumínio é um material que - FGV 2015
Química - 2015O espinélio de magnésio e alumínio é um material que apresenta uma combinação de propriedades de grande interesse tecnológico. Em uma das etapas para a produção desse material, Mg(OH)2 e Al(OH)3 são combinados na proporção molar 1:2, respectivamente. Na fórmula unitária do espinélio AB2Ox, a proporção dos íons magnésio e alumínio é a mesma da mistura reacional.
Um professor propôs um trabalho a um grupo de alunos - FGV 2015
Química - 2015Um professor propôs um trabalho a um grupo de alunos empregando um conjunto de 14 bolas de diferentes tipos de plásticos, para montar um modelo, com bolas e varetas, da estrutura molecular do acetato de etila, fórmula molecular C4 H8 O2 . Para o experimento, os alunos dispuseram de balança e régua.
Para representarem corretamente o modelo da molécula do C4 H8 O2 , as bolas de plástico tinham tamanhos diferentes (pequenas, médias e grandes). Suas massas, em gramas, eram iguais aos valores das massas molares dos elementos C, H e O. Em escala ampliada para centímetros, seus raios tinham a mesma ordem de tamanho dos raios atômicos dos átomos que representavam.
Sobre essas bolas de plástico que representam as características de tamanho e massa dos átomos de C, H e O, os alunos concluíram:
I. as bolas que representam os átomos de H eram as pequenas, e as que representam os átomos de O eram as grandes;
II. a massa total das bolas grandes correspondia a seis vezes a massa total das bolas de tamanho pequeno;
III. a massa total das bolas pequenas correspondia a ¼ da massa total das bolas de tamanho médio.
O faturamento da indústria farmacêutica no Brasil vem - FGV 2015
Química - 2015O faturamento da indústria farmacêutica no Brasil vem aumentando nos últimos anos e mantém forte potencial de crescimento. A população utiliza medicamentos preventivos de doenças, como a vitamina C, antinflamatórios de última geração, como a nimesulida, e medicação de uso continuado, como o propranolol.
(http://www.espm.br/Publicacoes/CentralDeCases/Documents/ACHE.pdf, http://qnint.sbq.org.br/qni/visualizarConceito.php?idConceito=14, Química Nova, vol. 36, n.º 8, 123-124, 2013)
Nas reações, apresentam-se as reações de hidrólise com os reagentes da vitamina C (I), da nimesulida (II) e do propranolol (III).
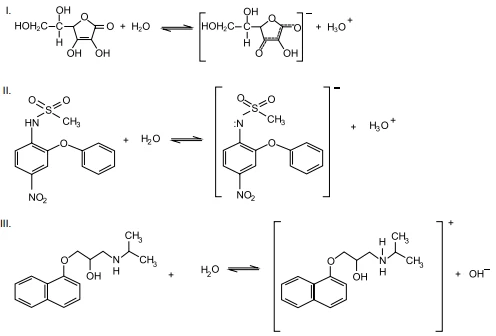
Alguns historiadores da Ciência atribuem ao filósofo - UNESP 2015
Química - 2015Alguns historiadores da Ciência atribuem ao filósofo présocrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo o que existe no mundo e sua transformação se dariam a partir de quatro elementos básicos: fogo, ar, água e terra. Hoje, a química tem outra definição para elemento: o conjunto de átomos que possuem o mesmo número atômico.
O consumo brasileiro total de explosivos não militares é da - FGV 2015
Química - 2015O consumo brasileiro total de explosivos não militares é da ordem de 200 mil t/ano por empresas mineradoras como a Vale (Carajás e Itabira), MBR, Yamana, dentre outras. O principal explosivo empregado é o nitrato de amônio, embalado em cartuchos. Sua ação como explosivo se deve à sua instabilidade térmica. Por meio da ignição de um sistema detonador, esse sal se decompõe resultando em produtos gasosos de acordo com a seguinte equação química:
NH4 NO3 → N2 (g) + 2 H2 O(g) + ½ O2 (g)
Uma das substâncias aglutinadoras que pode ser utilizada - UNESP 2015
Química - 2015Leia o texto para responder às questões de números 69 a 71.
No ano de 2014, o Estado de São Paulo vive uma das maiores crises hídricas de sua história. A fim de elevar o nível de água de seus reservatórios, a Companhia de Saneamento Básico do Estado de São Paulo (Sabesp) contratou a empresa ModClima para promover a indução de chuvas artificiais. A técnica de indução adotada, chamada de bombardeamento de nuvens ou semeadura ou, ainda, nucleação artificial, consiste no lançamento em nuvens de substâncias aglutinadoras que ajudam a formar gotas de água.
(http://exame.abril.com.br. Adaptado)
A cachaça é um produto genuinamente brasileiro reconhecido - FGV 2015
Química - 2015A cachaça é um produto genuinamente brasileiro reconhecido internacionalmente e registrado na Organização Mundial de Comércio. A produção artesanal, com a utilização de alambiques de cobre, atinge 300 milhões de litros por ano. Os apreciadores avaliam que o produto artesanal tem melhor qualidade e sabor do que o produzido em alambiques de aço inoxidável; entretanto a cachaça artesanal apresenta o teor de cobre residual que deve obedecer o limite máximo de 5 mg/L.
Além do iodeto de prata, outras substâncias podem ser - UNESP 2015
Química - 2015Leia o texto para responder às questões de números 69 a 71.
No ano de 2014, o Estado de São Paulo vive uma das maiores crises hídricas de sua história. A fim de elevar o nível de água de seus reservatórios, a Companhia de Saneamento Básico do Estado de São Paulo (Sabesp) contratou a empresa ModClima para promover a indução de chuvas artificiais. A técnica de indução adotada, chamada de bombardeamento de nuvens ou semeadura ou, ainda, nucleação artificial, consiste no lançamento em nuvens de substâncias aglutinadoras que ajudam a formar gotas de água.
(http://exame.abril.com.br. Adaptado)
O uso do radioisótopo rutênio-106 (106Ru) vem sendo - FGV 2015
Química - 2015O uso do radioisótopo rutênio-106 (106Ru) vem sendo estudado por médicos da Universidade Federal de São Paulo, no tratamento de câncer oftalmológico. Esse radioisótopo emite radiação que inibe o crescimento das células tumorais. O produto de decaimento radiativo do rutênio-106 é o ródio-106 (106Rh).
Para a produção de chuva artificial, um avião adaptado - UNESP 2015
Química - 2015Leia o texto para responder às questões de números 69 a 71.
No ano de 2014, o Estado de São Paulo vive uma das maiores crises hídricas de sua história. A fim de elevar o nível de água de seus reservatórios, a Companhia de Saneamento Básico do Estado de São Paulo (Sabesp) contratou a empresa ModClima para promover a indução de chuvas artificiais. A técnica de indução adotada, chamada de bombardeamento de nuvens ou semeadura ou, ainda, nucleação artificial, consiste no lançamento em nuvens de substâncias aglutinadoras que ajudam a formar gotas de água.
Os automóveis são os principais poluidores dos centros - FGV 2015
Química - 2015Os automóveis são os principais poluidores dos centros urbanos. Para diminuir a poluição, a legislação obriga o uso de catalisadores automotivos. Eles viabilizam reações que transformam os gases de escapamento dos motores, óxidos de nitrogênio e monóxido de carbono, em substâncias bem menos poluentes.
Os catalisadores __________ a energia de ativação da reação no sentido da formação dos produtos, __________ a energia de ativação da reação no sentido dos reagentes e __________ no equilíbrio reacional.
De modo geral, em sistemas aquáticos a decomposição de - UNESP 2015
Química - 2015Leia o texto para responder às questões de números 72 e 73.
Uma medida adotada pelo governo do estado para amenizar a crise hídrica que afeta a cidade de São Paulo envolve a utilização do chamado “volume morto” dos reservatórios do Sistema Cantareira. Em artigo publicado pelo jornal O Estado de S.Paulo, três especialistas alertam sobre os riscos trazidos por esse procedimento que pode trazer à tona poluentes depositados no fundo das represas, onde se concentram contaminantes que não são tratados por sistemas convencionais. Entre os poluentes citados que contaminam os mananciais há compostos inorgânicos, orgânicos altamente reativos com os sistemas biológicos, microbiológicos e vírus. Segundo as pesquisadoras, “quanto mais baixo o nível dos reservatórios, maior é a concentração de poluentes, recomendando maiores cuidados”.
(http://são-paulo.estadao.com.br. Adaptado)
A quantidade de oxigênio necessário para degradar - UNESP 2015
Química - 2015Leia o texto para responder às questões de números 72 e 73.
Uma medida adotada pelo governo do estado para amenizar a crise hídrica que afeta a cidade de São Paulo envolve a utilização do chamado “volume morto” dos reservatórios do Sistema Cantareira. Em artigo publicado pelo jornal O Estado de S.Paulo, três especialistas alertam sobre os riscos trazidos por esse procedimento que pode trazer à tona poluentes depositados no fundo das represas, onde se concentram contaminantes que não são tratados por sistemas convencionais. Entre os poluentes citados que contaminam os mananciais há compostos inorgânicos, orgânicos altamente reativos com os sistemas biológicos, microbiológicos e vírus. Segundo as pesquisadoras, “quanto mais baixo o nível dos reservatórios, maior é a concentração de poluentes, recomendando maiores cuidados”.
(http://são-paulo.estadao.com.br. Adaptado)
Fontes alternativas de energia têm sido foco de interesse - FGV 2015
Química - 2015Fontes alternativas de energia têm sido foco de interesse global como a solução viável para crescentes problemas do uso de combustíveis fósseis. Um exemplo é a célula a combustível microbiológica que emprega como combustível a urina. Em seu interior, compostos contidos na urina, como ureia e resíduos de proteínas, são transformados por micro-organismos que constituem um biofilme no anodo de uma célula eletroquímica que produz corrente elétrica.
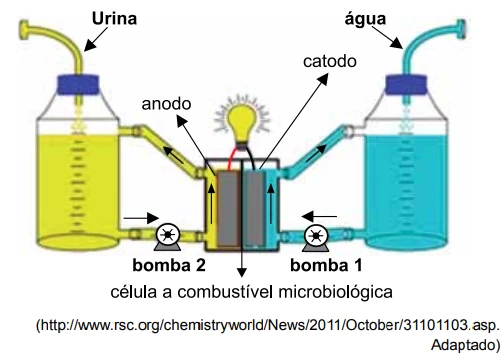
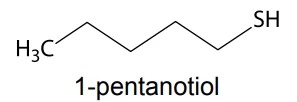
A degradação anaeróbica de matéria orgânica contendo - UNESP 2015
Química - 2015A degradação anaeróbica de matéria orgânica contendo enxofre pode levar à formação de substâncias com odores altamente desagradáveis. Dentre essas substâncias estão o gás sulfídrico (H2S) e as mercaptanas, como a pentamercaptana (1-pentanotiol).
As fosfinas, PH3 , são precursoras de compostos empregados - FGV 2015
Química - 2015As fosfinas, PH3 , são precursoras de compostos empregados na indústria petroquímica, de mineração e hidrometalurgia. Sua obtenção é feita a partir do fósforo elementar, em meio ácido, sob elevada pressão, e a reação se processa de acordo com
P4 + H2 O → PH3 + H3 PO4
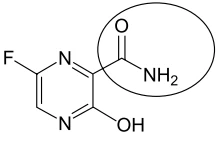
O surto da doença ebola já atinge vários países da África, - FGV 2015
Química - 2015O surto da doença ebola já atinge vários países da África, causando centenas de mortes. O Japão pode oferecer uma medicação, o favipiravir. Entretanto, ela ainda não recebeu aprovação para uso.
(http://info.abril.com.br/noticias/ciencia/2014/08/japao-pode-oferecermedicamento-sem-aprovacao-para-ebola.shtml. Adaptado)
O texto seguinte refere-se a um documento do Departamento - FGV 2015
Química - 2015O texto seguinte refere-se a um documento do Departamento Nacional de Produção Mineral e descreve a utilidade de um combustível fóssil:
A utilidade do combustível X pode ser vinculada às suas propriedades, como o alto poder calorífico por unidade de massa, já que o calor resultante da sua queima aquece caldeiras, que geram vapor, que movimentam turbinas, que geram energia elétrica. O gás produzido por esse combustível pode resultar em fertilizantes, amônia, combustíveis líquidos, lubrificantes, combustível para aviação e isqueiros, metanol, etc.
Considerando o conjunto de informações apresentadas no - FATEC 2015/2
Química - 2015Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270º aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução, envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
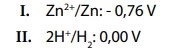
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta

De acordo com a imagem e as informações fornecidas no - FATEC 2015/2
Química - 2015Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270º aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução, envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
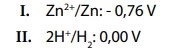
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta

A diferença de potencial (ΔE0), em volts, gerada por - FATEC 2015/2
Química - 2015Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270º aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução, envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
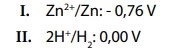
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta

A imagem apresenta duas semirreações, sendo uma de um - FATEC 2015/2
Química - 2015Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270º aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução, envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
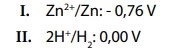
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta

Em 1859, surgiram experimentos para a construção de uma - FATEC 2015/2
Química - 2015Em 1859, surgiram experimentos para a construção de uma bateria para acumular energia elétrica, as baterias de chumbo, que passando por melhorias ao longo dos tempos, tornaram-se um grande sucesso comercial especialmente na indústria de automóveis.
Essas baterias são construídas com ácido sulfúrico e amálgamas de chumbo e de óxido de chumbo IV, em caixas confeccionadas com o polímero polipropileno.
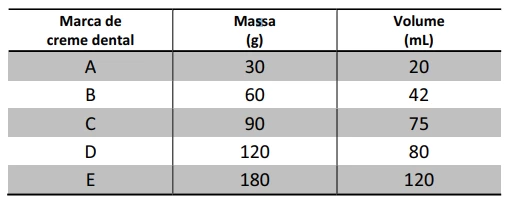
Cinco cremes dentais de diferentes marcas têm os mesmos - FUVEST 2015
Química - 2015Cinco cremes dentais de diferentes marcas têm os mesmos componentes em suas formulações, diferindo, apenas, na porcentagem de água contida em cada um. A tabela a seguir apresenta massas e respectivos volumes (medidos a 25°C) desses cremes dentais.
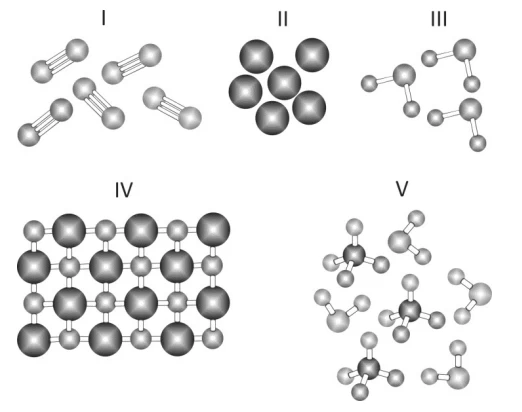
Considere as figuras a seguir, em que cada esfera - FUVEST 2015
Química - 2015Considere as figuras a seguir, em que cada esfera representa um átomo.
A Gruta do Lago Azul (MS), uma caverna composta por um - FUVEST 2015
Química - 2015A Gruta do Lago Azul (MS), uma caverna composta por um lago e várias salas, em que se encontram espeleotemas de origem carbonática (estalactites e estalagmites), é uma importante atração turística. O número de visitantes, entretanto, é controlado, não ultrapassando 300 por dia. Um estudante, ao tentar explicar tal restrição, levantou as seguintes hipóteses:
I. Os detritos deixados indevidamente pelos visitantes se decompõem, liberando metano, que pode oxidar os espeleotemas.
II. O aumento da concentração de gás carbônico que é liberado na respiração dos visitantes, e que interage com a água do ambiente, pode provocar a dissolução progressiva dos espeleotemas.
III. A concentração de oxigênio no ar diminui nos períodos de visita, e essa diminuição seria com - pensada pela liberação de O2 pelos espeleotemas.
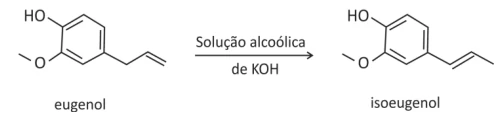
O eugenol, extraído de plantas, pode ser transformado em - FUVEST 2015
Química - 2015O eugenol, extraído de plantas, pode ser transformado em seu isômero isoeugenol, muito utilizado na indústria de perfumes. A transformação pode ser feita em solução alcoólica de KOH.
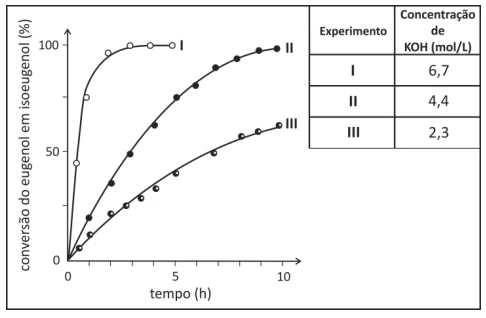
Foram feitos três experimentos de isomerização, à mesma temperatura, empregando-se massas iguais de eugenol e volumes iguais de soluções alcoólicas de KOH de diferentes concentrações. O gráfico a seguir mostra a porcentagem de conversão do eugenol em isoeugenol em função do tempo, para cada experimento.
Um estudante utilizou um programa de computador para - FUVEST 2015
Química - 2015Um estudante utilizou um programa de computador para testar seus conhecimentos sobre concentração de soluções. No programa de simulação, ele deveria escolher um soluto para dissolver em água, a quantidade desse soluto, em mol, e o volume da solução. Uma vez escolhidos os valores desses parâmetros, o programa apresenta, em um mostrador, a concentração da solução. A tela inicial do simulador é mostrada a seguir.
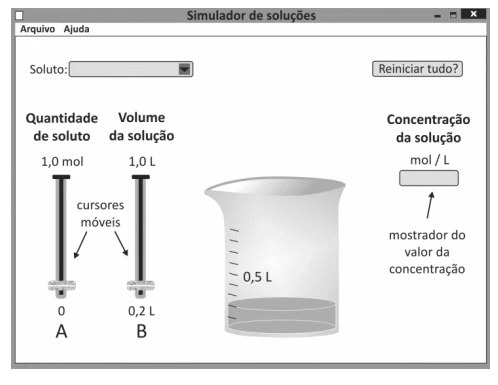
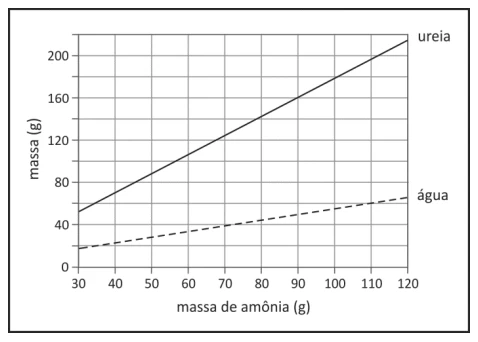
Amônia e gás carbônico podem reagir formando ureia e - FUVEST 2015
Química - 2015Amônia e gás carbônico podem reagir formando ureia e água. O gráfico a seguir mostra a massa de ureia e de água que são produzidas em função da massa de amônia, considerando as reações completas.
Apoie nosso trabalho!
Assine Agora