Disciplina: Química 0 Curtidas
A variação de entalpia, associada à - UNESP 2022/Biológicas
A variação de entalpia, associada à formação de um cristal iônico sólido a partir de seus íons no estado gasoso, é conhecida como energia reticular. Essa energia é difícil de ser medida diretamente, mas pode ser calculada de forma indireta, utilizando-se a Lei de Hess, a partir de outras transformações, cuja variação de entalpia é conhecida. Esse caminho para a determinação da energia reticular é conhecido como ciclo de Born-Haber. O diagrama a seguir mostra as etapas desse ciclo para o cloreto de sódio (NaCl).
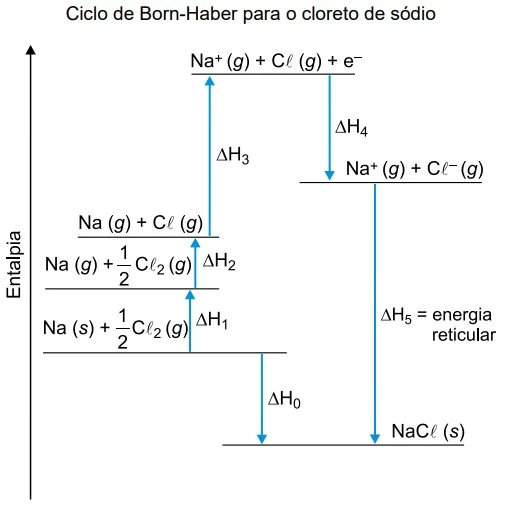
Nesse diagrama, a sublimação do sódio metálico, a primeira energia de ionização do elemento sódio e a afinidade eletrônica do elemento cloro correspondem, respectivamente, aos valores de
-
ΔH2, ΔH3 e ΔH4
-
ΔH1, ΔH0 e ΔH5
-
ΔH1, ΔH4 e ΔH3
-
ΔH2, ΔH4 e ΔH3
-
ΔH1, ΔH3 e ΔH4
Solução
Alternativa Correta: E) ΔH1, ΔH3 e ΔH4
Sublimação do sódio metálico:
Na(s) → Na(g) ΔH1 Primeira energia de ionização do elemento sódio:
Na(g) → Na+(g) + e- ΔH3
Afinidade eletrônica do elemento cloro:
Cl(g) + e- → Cl-(g) ΔH4
Resolução adaptada de: Curso Objetivo
Institução: UNESP
Ano da Prova: 2022
Assuntos: Sublimação
Vídeo Sugerido: YouTube